Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
Em um espectrômetro de absorção atômica de chama é desnecessária a utilização de fonte de radiação, pois a chama já possui a função de atomizar e excitar os átomos de interesse.
O que dá identidade a um elemento químico, tornando-o único, é o número de
Na2 SO4(aq)+ BaCl 2(aq)→ BaSO 4(s)+ 2NaCl (aq)
A quantidade máxima de sulfato de bário que se forma é, aproximadamente, de
Zn + HCl → ZnCl2 + H2
A massa de HCl necessária para reagir completamente com 130 g de zinco é
Dados: mH = 1u, mCl = 35u e mZn = 65u
Ca + 2 H2 O → Ca(OH) 2 + H2
Qual a massa, em gramas, de H2 produzido na reação?
Dados: mH = 1u, mO = 16u e mCa = 40u
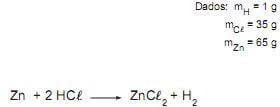

Qual a massa, em gramas, de gás carbônico que é produzida nessa reação se são consumidos 100 g de carbonato de cálcio?
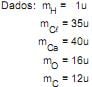
Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
Reação 1:
2 Mg(s) + O2 (g) 2MgO(s): reação que acontece em flashes descartáveis de fotografia.
Reação 2:
2NaN3 (s) 3N2 (g) + 2Na(s): reação advinda do acionamento de dispositivos de segurança presentes nos automóveis, chamados airbags. A decomposição do NaN3 (s) origina N2 (g), que os faz inflar.
Reação 3:
Zn(s) + 2HC(aq) ZnC
 2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC
2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC 2 (aq) e gás hidrogênio.
2 (aq) e gás hidrogênio.Reação 4:
BaC
 2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado.
2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado. Após analisar essas reações, uma estudante de Química fez as seguintes afirmações:
I – As reações 1 e 3 são de “síntese”, e a reação 2 é de “decomposição”.
II – As reações 3 e 4 são, respectivamente, de “simples troca” e de “dupla troca”.
III – A reação 2 é de decomposição.
IV – A reação 1 é de síntese.
Com base na teoria das classificações das reações químicas, a estudante fez afirmações corretas APENAS em




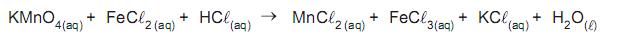
Com base nos coeficientes da equação balanceada, a proporção estequiométrica de reação entre as espécies KMnO4 e FeCl2 é
Substância Porcentagem
Sílica (SiO2 ).................................72%
Alumina (Al2 O3 ) .........................0,7%
Sulfato de sódio (Na2 SO4 ).........14%
Cal (CaO)..................................... 9%
Óxido de magnésio (MgO)............ 4%
Óxido de potássio (K2 O)...............0,3%
A respeito das substâncias que fazem parte da composição química do vidro, tem-se que
I - Obtenção de gelo seco a partir de gás carbônico
II - Queima de uma vela
III - Sal obtido a partir da água do mar
IV - O reflexo da luz solar em um lago
V- A formação da ferrugem em uma estrutura metálica São fenômenos obtidos por transformações químicas APENAS os apresentados em
6Fe2+(aq) + Cr2O72-(aq) + 14H+(aq) ? 6Fe3+(aq) + 2Cr3+(aq) + 7H2O(L)
Qual é a percentagem em massa de ferro na amostra?