Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.136 questões
I- Os elementos do grupo VII A ou 17 da Tabela Periódica são os mais eletronegativos de seus períodos.
II- A diferença de eletronegatividade entre o Hidrogênio e o Enxofre é suficiente para estabelecer em ligações iônicas.
III-A eletronegatividade dos ametais diminui quando o número relativo a sua camada de valência aumenta.
IV-Os metais cuja camada de valência apresenta configuração s1 são os de menor eletronegatividade de seus períodos.
Estão corretas:
I- Óxidos neutros não reagem com a água.
II- ONa2O reage com ácido formando sal e água.
III-O óxido Cl2O3 pode reagir para formar ácido.
IV-Os óxidos ácidos apresentam ligações covalentes.
Estãocorretas:
O volume, em litros, obtido do produto quando são consumidas 2,71x1024moléculas de Hidrogênio, nas CNTP, é igual a:
I- Zn+2HCl→ H2+ZnCl2
II- 2NaBr+Cl2 → 2NaCl+Br2
III- Ca+FeSO4 → Fe+CaSO4
IV- Al+3HCl→ 3/2H2+AlCl3
V- 2KF+Cl2 → 2KCl+F2
Em função da reatividade dos metais e dos halogênios, podemosafirmarqueocorremasreações:
I- metal alcalino-terroso
II- em sais pode ter número de oxidação-1
III- em sais pode ter número de oxidação+7
IV- sua configuração eletrônica termina com s1
Os seguintes elementos correspondem respectivamente às informações I a IV:
I. Oxigênio: gás indispensável para a sobrevivência dos seres vivos. Ele reage com certas substancias presentes no corpo dos seres vivos e produz água, energia e gás carbônico. A energia produzida nessa reação é responsável pela manutenção da vida de todo os seres;
II. Nitrogênio: é vital para as plantas, as mesmas absorvem o gás carbônico e eliminam oxigênio, tal processo é conhecido como fotossíntese;
III. Gases raros: não são aproveitados pelo nosso organismo, mas são utilizados em outras tarefas que são de grande proveito para o ser humano, por exemplo, o argônio – utilizado em lâmpadas incandescentes.
Está(ão) correto(s) o(s) item(ns):
A reação que melhor descreve esse processo é
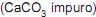 que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado.
que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado. O teor de carbonato de cálcio na amostra de minério analisada é
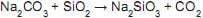
A cor do vidro muitas vezes depende das impurezas de ferro que estão presentes na areia quando o vidro é formado.
Empregando-se 1 tonelada de areia
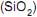 contendo 4% de impurezas em ferro na fabricação do vidro, a quantidade de litros de gás recolhido a 27ºC, considerando que esse processo seja realizado na cidade do Rio de Janeiro, é
contendo 4% de impurezas em ferro na fabricação do vidro, a quantidade de litros de gás recolhido a 27ºC, considerando que esse processo seja realizado na cidade do Rio de Janeiro, é 
Dados: Eletronegatividades na escala de Pauling B=2,04; O=3,44; Na=0,93; Al=1,61; Si=1,90 e Ca=1,00
Assinale a opção que indica o íons que apresenta o menor raio iônico.
Dados: Números atômicos: Ca = 20, Cl = 17, Mg = 12, K = 19,Na = 11
N2(g)+ O2(g) →2NO(g)
Essa equação representa uma reação que pode ser classificada como
A configuração eletrônica desse íon, segundo o diagrama de Pauling, tem como subnível mais energético, Dados: Número atômico do ferro = 26