Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
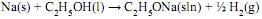
Para eliminar um resíduo de 230 mg de sódio, a massa necessária de etanol é, em miligramas, igual a
I - N2 e O2 não podem ser comprimidos até a liquefação.
II - N2 e O2 não são ?uidos, por serem gases razoavelmente inertes.
III - A densidade do ar é maior que a do nitrogênio nas condições normais de temperatura e pressão.
Dados
MO = 16 g mol -1
MN = 14 g mol -1 )
Está correto APENAS o que se afirma em
Dados
MO = 16 g mol -1
MN = 14 g mol -1
MH = 1 g mol -1
5H2 C2 O4 + 2KMnO4 + 6H+
→
10 CO2 + 2Mn2+ + 8H2 OO volume, em mL, de solução de KMnO4 0,165 mol/L, necessário para reagir com 108 mL de ácido oxálico, de igual concentração molar, é
H2 + 1/2 O2 → H2O
Nesse processo, quantos mols de O2 são necessários para produzir 10 mols de H2 O?
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
Um estudante investigou as propriedades físicas e químicas de um gás e em seguida preparou um relatório, no qual anotou o seguinte:
1. O gás é incolor e inodoro.
2. Quando borbulhado em um frasco contendo água de cal, (solução de hidróxido de cálcio), a solução fica turva, devido à formação de um precipitado branco leitoso.
3. Quando borbulhado em um frasco contendo água destilada, a solução resultante é levemente ácida.
4. O gás extingue a chama de uma vela acesa.
5. O gás é o dióxido de carbono.
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

A perda por calcinação, expressa em percentual de CO2 na amostra original é de:
(Dados: Fe = 56 e O =16)
(Dado: S = 32 e O = 16)
(Dado: Zn = 65,5)