Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
De acordo com a tabela periódica atual, os elementos de um
mesmo período, por apresentarem o mesmo número de elétrons
de valência, formam compostos químicos com características
semelhantes.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
As primeiras propostas de tabela periódica baseavam-se
na massa atômica dos elementos como critério de alocação dos
elementos ao longo da tabela, o que causava algumas
incoerências que, mais tarde, foram sanadas com a adoção
do número atômico como critério.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente
com 6,0 gramas de C(s), de acordo com a reação I,
e que m2 gramas de O2(g) reajam completamente com
6,0 gramas de C(s), de acordo com a reação II. Conforme
a lei de Richter, são necessários 2 × m1 gramas de H2(g) para
reagir completamente com m2 gramas de O2(g), de acordo
com a reação III.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023
moléculas de H2(g) para a formação de 32,0 g de metano.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão,
na mesma proporção molar da reação apresentada, a queima
de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto
de potássio (K2S).
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato
de potássio e o cátion do nitrato de alumínio é maior que
250,0 g/mol.
O elemento químico chamado Rubídio (Rb) apresenta a seguinte configuração eletrônica :
Com base em sua configuração eletrônica , pode-se afirmar que o Rubídio no sistema de classificação periódica dos elementos pertence ao grupo dos:
Átomos diferentes que apresentam o mesmo número de nêutrons são chamados:
A configuração eletrônica do átomo de Flúor que possuiZ = 9 e A = 19 é apresentada na alternativa :
As Estações de Tratamento de Água (ETA) utilizam gás cloro no processo de desinfecção, que consiste na utilização de um agente químico ou não químico para inativação de microrganismos patogênicos presentes na água. Um método para obtenção desse gás está representado a seguir, pela equação química não balanceada
HCl + MnO2 → MnCl2 + H2O + Cl2
Se reagirmos 100,0 g de HCl com 100,0 g de MnO2, encontraremos que o reagente limitante e a massa de gás cloro obtida nessas condições, expressa em gramas, serão, respectivamente,
Dados: Massas molares (g mol-1): H = 1; O = 16; Cl = 35,5; Mn = 55
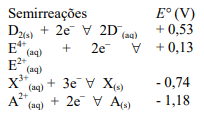
Observe a reação:
2H2O → 2H2 + O2
Essa reação da água em corrente elétrica é caracterizada
por ser uma reação de
Observe a figura que representa as informações sobre o elemento químico sódio, presente na tabela periódica.
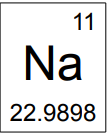
Os números apresentados acima e abaixo do símbolo do
sódio são, respectivamente:
