Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
Ca5(PO4)3 F + H3PO4 + H2O HF + Ca(H2PO4)2 . H2O (I)
Em um processo industrial, partiu-se de 1 tonelada de fluorapatita fazendo-a reagir com uma quantidade suficiente de ácido fosfórico obtendo-se, ao final, 2 toneladas do produto di-hidrogenofosfato de cálcio monohidratado. Pode-se, por esses dados, prever que a pureza do mineral utilizado, em percentual, era aproximadamente igual a:
(Dados, em g/mol: Ca= 40, P=31, O=16, H=1, F=19)
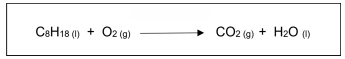
Para queimar completamente 2,00 mols de octano, serão necessários:
Fonte: BBC Brasil, 2023. Disponível em: https://www.bbc.com/portuguese/articles/c7246ee619qo
Em relação às características físico-químicas e ambientais do mercúrio, podemos afirmar que:
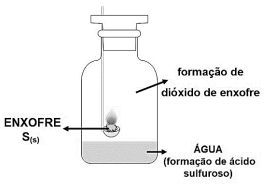
Certa quantidade de enxofre é inserida no dispositivo de combustão e a chama é iniciada no bico de Bunsen. Então, ainda com a chama acesa, o dispositivo é inserido em um frasco hermeticamente fechado e o dióxido de enxofre formado fica confinado no recipiente. Este gás, por sua vez, reage com a água contida no fundo do frasco, formando uma solução de ácido sulfuroso. Considerando todas as informações apresentadas e a imagem, a reação que expressa corretamente a formação do ácido sulfuroso é:
A respeito de estequiometria, processo de fabricação, corrosão e soldagem, julgue o item a seguir.
Considere-se que a reação para a produção de biodiesel ocorra a partir de 1 mol de triglicerídeo (TRIG) e 3 mols de metanol (MET), na presença de um catalisador (NaOH), para formar monoésteres de ácidos graxos (BIO = biodiesel) e 1 mol de glicerina (GLI), conforme a equação que se segue.
1 TRIG + 3 MET → BIO + 1 GLI
Com base nessa hipótese e considerando-se a massa molar
do metanol igual a 32 g/mol e a massa molar da glicerina
igual a 60 g/mol, é correto afirmar que, se forem utilizados
960 kg de metanol na presença de um excesso de
triglicerídeos, para um rendimento de 80% a massa
resultante de glicerina será de 480 kg.
Julgue o item seguinte, referentes ao estudo dos gases.
Os gases diferem de líquidos e sólidos, pois o volume de
uma amostra de gás depende fortemente de sua temperatura e
da pressão que lhe é aplicada. Experimentalmente,
descobriu-se que todos os gases comuns se comportam
aproximadamente da mesma maneira, sendo esse
comportamento descrito pelas leis dos gases. Assim, para
quase todos os gases, o volume de uma amostra de gás a
temperatura constante é inversamente proporcional à
pressão.
Julgue o item seguinte, referentes ao estudo dos gases.
A investigação da relação entre o volume e a temperatura de
um gás mostra que gases sofrem contração quando sujeitos a
um aumento significativo de temperatura. Quando a pressão
e a quantidade de matéria de um gás são mantidas
constantes, o volume desse gás é inversamente proporcional
à temperatura.
Acerca da natureza elétrica da matéria, julgue o próximo item.
Conforme o modelo atômico de Dalton, também conhecido
como modelo pudim de passas, o átomo é tal qual uma esfera
de material gelatinoso com carga positiva sobre a qual os
elétrons ficam suspensos.
Se uma peça de aço carbono que contém 5 g de ferro for completamente oxidada pelo H2S, serão formados mais de 8 g de mackinawita.
Considerando o texto apresentado, avalie as proposições a seguir:
I- Modelo bola de bilhar: Dalton teve a ideia de que deveria ser algo maciço muito pequeno e indivisível, chamado de átomo.
II- Modelo pudim de passas: Thompson identificou partículas negativas, denominadas de elétrons, e supôs que também deveria haver prótons.
III- Modelo Rutherford-Bohr: Rutherford determinou que o átomo é formado por duas regiões (o núcleo e a eletrosfera) e Bohr inferiu que havia neutros permitindo que houvesse um espaço entre as camadas de elétrons dos átomos.
É CORRETO o que se afirma em:
Com base nessas informações, julgue o próximo item.
A degradação do ozônio é uma reação de dissociação.
Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de
ozônio reage com o oxigênio atômico, é bimolecular.

Com base nessas informações, julgue o próximo item.
A degradação da dipirona ocorre por hidrólise.