Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
Leia o texto:
O “sal marinho”, por não passar pelo processo químico do sal comum, tem uma quantidade menor de aditivos químicos como conservantes e corantes associados ao desenvolvimento de câncer. Ele mantém maior quantidade de minerais como cálcio, potássio, ferro, zinco e iodo.
O Globo, 16.3.2023, p.23.
Assinale a opção em que todos os elementos citados formam
naturalmente cátions bivalentes.
I.Os adeptos utilizavam a hipótese para compreender as reações químicas em relação às fórmulas e ao peso das substâncias.
EM CONTRAPARTIDA,
II.Os opositores questionavam a ausência direta da existência dos átomos e os métodos utilizados pelos cientistas da época.
Fonte: Mortimer, E, et al. Matéria, energia e vida, uma abordagem interdisciplinar: materiais, luz e som: modelos e propriedades. São Paulo: Editora Scipione, 2020.
A partir da análise dessas asserções, é possível AFIRMAR que:
(Adaptado de F.A.G. Parente, A.C.F. dos Santos, A.C. Tort. Revista Brasileira de Ensino de Física, v. 35, n. 4, 4301, 2013)
A proposta de que os elétrons se movem ao redor do núcleo em determinadas camadas ou níveis de energia, sendo que a energia é maior quanto mais distante do núcleo está a partícula é do físico
I.A água pesada (D2O) é uma forma de água onde os átomos de hidrogênio são substituídos por deuterium, um isótopo do hidrogênio.
II.A densidade do gelo de D2O é quase idêntica à densidade da água líquida de D2O.
III.O ponto de fusão do gelo de água pesada (D2O) é maior que o do gelo de água comum (H2O).
É correto o que se afirma em:
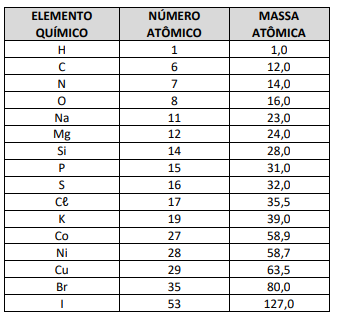
Em relação aos elementos químicos mencionados anteriormente, analise as afirmativas abaixo. ]
I. Os ametais citados pertencem ao grupo dos calcogênios e ao grupo dos halogênios, possuindo seis e sete elétrons no subnível mais energético respectivamente.
II. Todos os metais citados pertencem ao quarto período da classificação periódica e possuem elétrons distribuídos em quatro camadas eletrônicas.
III. Existem na relação acima dois ametais que apresentam propriedades semelhantes às do oxigênio, pois possuem o mesmo número de elétrons na camada de valência.
IV. Todos os metais citados são elementos de transição e apresentam na camada de valência elétrons distribuídos no subnível d.
Estão corretas as afirmativas:
( ) Sommerfeld propõe que a energia do elétron seria determinada pela distância em que ele se encontra do núcleo e pelo tipo de órbita que descreve.
( ) Hantaro Nagaoka, em 1903, sugeriu um modelo atômico formado por pares de cargas positivas e negativas, aos quais chamou de “dinamidas”. E estes pares de cargas ficariam em blocos flutuantes no espaço.
( ) Em 1904, Philipp Lénard publicou no Japão uma descrição do carbono, bem moderna para época, ele sugeriu que o átomo era constituído de um anel de elétrons ao redor de um centro muito denso.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. O físico inglês J. J. Thomson, em 1887, mostrou que as partículas em raio catódico são carregadas negativamente e ele provou esta afirmação mostrando que o raio pode ser desviado se passar entre placas de metais carregados opostamente em um tudo de Crookes. Segundo suas pesquisas, a direção do desvio para a placa carregada positivamente, mostra que as partículas do raio catódico carregam uma carga elétrica negativa.
II. Segundo os pesquisadores dos modelos atômicos, foi no ano de 1908, que Robert Millikan, um físico americano realizou, um clássico experimento, que foi capaz de determinar a magnitude da carga negativa do elétron. Millikan acreditava que os raios x chocavam-se com os elétrons das moléculas do ar que circundavam as gotículas de óleo e que as gotículas poderiam captar estes elétrons. Através de seus experimentos, Milikan foi assim capaz de mostrar que todos os elétrons são idênticos, isto é, todos têm a mesma massa e carga.
III. Embora para a maioria dos cientistas da época o fato do átomo ser constituído por uma parte carregada positivamente e por alguns elétrons, em 1890, isto ainda não era totalmente claro. Em 1898, que J. J. Thomson sugeriu que um átomo poderia ser uma esfera carregada positivamente na qual alguns elétrons estão incrustados. Segundo ele, isto levaria a uma impossível remoção de elétrons dos átomos.
Estão corretas as afirmativas:
Dia da Vodka: descubra algumas informações interessantes sobre a bebida
“No dia 04 de outubro se comemora o Dia da Vodka. A Vodka é uma popular bebida destilada que caiu nas graças de quem aprecia um drink ... Como surgiu a Vodka? Foi no ano de 1865, na Rússia, que o renomado cientista Dmitri Ivanovich Mendeleev decidiu misturar álcool e água em diferentes proporções durante um ano. Depois de várias experiências, ele encontrou aquilo que seria o ideal: 40% de álcool e 60% de água”. (Adaptado)
Fonte: https://www.segs.com.br/demais/313189-dia-da-vodka-descubra-algumasinformacoes-interessantes-sobre-abebida#:~:text=No%20dia%2004%20de%20outubro,ela%20%C3%A9%20capaz %20de%20oferecer. Acesso em 09/01/2023
O renomado cientista russo citado na reportagem também foi o responsável pela criação de um dos mais importantes trabalhos da Ciência mundial denominado:
ma(Mn) = 55u.
HCl + Al(OH)3 → X + Y Ácido Hidróxido de Clorídrico Alumínio
Assinale a alternativa correta quanto aos produtos X e Y.
Adaptado. Disponível em: https://mundoeducacao.uol.com.br/quimica/atomo.htm#:~:text=O%2 0%C3%A1tomo%20%C3%A9%20a%20unidade,explicar%20o%20f uncionamento%20da%20mat%C3%A9ria. Acesso: 06/04/2023.
Observe o quadro abaixo:
1. Modelo do Pudim de Passas ( ) Partícula alfa (radioatividade) 2. Modelo da Bola de Bilhar ( ) Eletrólise (eletricidade) 3. Modelo Planetário (Sistema Solar) ( ) Massas (Leis Ponderais)
Neste contexto, marque a sequência correta entre o Modelo Atômico e os experimentos/ temas científicos realizados.
Adaptado. Disponível em: https://brasilescola.uol.com.br/o-quee/quimica/o-que-e-atomo.htm. Acesso: 06/04/2023.
Com relação aos modelos atômicos, assinale a alternativa correta.
I. Todos os elementos da tabela periódica foram forjados nos processos de vida e morte das estrelas. II. A composição do universo muda continuamente em decorrência do ciclo de vida das estrelas. III. Os elementos químicos que serão produzidos no decorrer do ciclo de vida de uma estrela dependem da massa da estrela.
Estão corretas as afirmativas:
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por:
Analisando as propriedades mencionadas no texto, para o grupo 12 e partindo do zinco em direção ao mercúrio, é possível prever tendência de: