Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua
camada de valência.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação
semimetais.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
A eletronegatividade é a quantidade de energia envolvida no
processo em que o átomo isolado em seu estado fundamental
recebe um elétron.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
Não procede a concepção reducionista da alquimia como práticas da Idade Média e do Renascimento que buscavam a transformação de metais menos nobres em ouro. Da mesma forma, não se pode simplificar dizendo-se que a transição da alquimia à química corresponde à ascensão da primeira em ciência. A alquimia, segundo algumas concepções, não pode ser considerada a origem da química, pois se restringia muito a concepções filosóficas da vida.
Internet:<http://www.qnesc.sbq.org.br/> (com adaptações).
Considerando o assunto do texto precedente, julgue o item que se segue.
A transformação de metais citada no texto assemelha-se
à atual transmutação dos elementos, como, por exemplo,
aquela que ocorre na síntese dos elementos com número
atômico maior que o do urânio na tabela periódica.
I. Quando o sulfeto de chumbo e o óxido de chumbo são aquecidos juntos, os produtos são chumbo metálico e dióxido de enxofre. Se 14 g de óxido de chumbo reagem, forma-se 9,42 x 10-2 mol de átomos de chumbo. II. O mais importante processo comercial para converter N2 do ar em compostos contendo nitrogênio é baseado na reação de N2 e H2 para formar NH3. São formadas 4 mols de NH3 a partir de 3 mols de N2 e 6 mols de H2. III. Xileno é uma substância composta somente de carbono e hidrogênio. Uma amostra de xileno foi queimada em excesso de oxigênio e este produziu somente como produtos 33,4 g de CO2 e 8,55 g de água. A fórmula empírica do xileno é C4H5.
Está correto o que se afirma em
I. Os elementos em um grupo da tabela têm propriedades similares porque apresentam o mesmo tipo de organização dos elétrons na periferia dos átomos. II. Todos os metais, com exceção do mercúrio, são sólidos à temperatura ambiente. III. Enxofre, fósforo, selênio e telúrio são elementos não-metálicos.
Está correto o que se afirma em
( ) De acordo com a teoria de Bohr, o elétron do átomo de hidrogênio no estado fundamental pode absorver várias quantidades discretas de energia e, assim, elevar-se a um nível de energia mais alto. ( ) A teoria atômica de Dalton explicou as leis da combinação química propondo que a matéria consiste em átomos indestrutíveis com massas que não mudam no decorrer das reações químicas. ( ) Quando elétrons absorvem ou emitem energia ao passarem de uma órbita eletrônica para outra, a energia é dada pela equação: E = mZ2e 4 . h. ( ) Os raios catódicos são um fluxo de elétrons que se movem em linha reta e são dependentes do material dos eletrodos e do gás residual que existe no tubo.
A sequência está correta em
Fe2O3(s) + 3CO(g) → 2 Fe(s) + 3CO2(g)
Com 75 g de Fe2O3 como reagente limitante, qual é o rendimento percentual se o rendimento real de Fe no teste foi 36,7 g?
I. As afinidades eletrônicas dos gases nobres são todas positivas, porque o elétron adicionado ocuparia um novo subnível de energia mais alta.
II. A diminuição na energia de ionização do Berílio ao Boro ocorre porque os elétrons no orbital preenchido 2s são mais eficientes em blindar os elétrons no subnível 2p do que são em se blindarem.
III. Em uma série isoeletrônica, o tamanho dos átomos aumenta com o aumento da carga nuclear à medida que os elétrons são atraídos mais fortemente pelo núcleo.
Está correto o que se afirma em
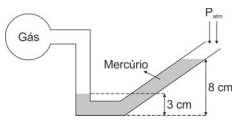
Sabendo que a pressão atmosférica local é de 76 cmHg, a pressão do gás é
25 mL de HCl aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
25 mL de CH3COOH aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
São feitas as seguintes afirmações sobre as titulações:
I - O pH no ponto de equivalência é 7 em ambas as titulações.
II - O pH no ponto de equivalência é neutro na titulação HCl/NaOH e básico na titulação CH3COOH/NaOH.
III - O pH no ponto final é básico em ambas as titulações.
IV - O volume gasto em ambas será de aproximadamente 25 mL de NaOH.
Quais estão corretas?
I - H2O apresenta maior temperatura de ebulição do que H2S, pois apresenta ligações de hidrogênio.
II - SiCl4 tem maior momento de dipolo que SCl2, pois apresenta maior número de ligações polares C-Cl.
III - H2O e H2S apresentam temperaturas de ebulição semelhantes, pois apresentam ligações de hidrogênio. Além disso, apresentam momentos de dipolo semelhantes, pois apresentam estrutura angular.
Quais estão corretas?
