Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
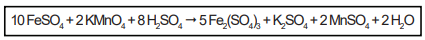
Nessa reação, o elemento químico que sofre oxidação tem como símbolo:
A fórmula química desse composto corresponde a:
NaHCO3(s) + H3 O+ (aq) → Na+ (aq) + 2H2 O(l) + CO2(g)
Considerando-se a proporção estequiométrica e o rendimento completo de reação, a massa de bicarbonato de sódio necessária para neutralizar 20,0 L de solução aquosa, cujo pH medido foi 2, é
Nessa situação final, a temperatura do balão, em K, é
Dado T(K) = T(°C) + 273
Por volta de 1920, dois cientistas, o bioquímico russo Aleksandr I. Oparin (1894 - 1980) e o biólogo inglês John B. S. Haldane (1892 - 1964) apresentaram seus resultados baseados no estudo da teoria da evolução química do biólogo inglês Thomas H. Huxley (1825 - 1895). Segundo a teoria, a Terra primitiva continha compostos químicos inorgânicos, que combinados a fenômenos físicos como descargas elétricas produziriam compostos orgânicos, que são a base da vida na Terra. Porém, esta hipótese só foi testada em laboratório em 1953 pelos cientistas Stanley L. Miller (1930 - 2007) e Harold C. Urey (1893 - 1981).
PILLING, S. Química prebiótica e formas de vida primitiva. Astroquímica, Universidade do Vale da Paraíba. Disponível em: <https://www1.univap.br/spilling/AQ/Aula%2015%20- %20Quimica%20prebiotica.pdf>. Acesso em: 13 ago. 2023.
A hipótese de Oparin e Haldane foi testada por Miller e Urey, que inseriram em um sistema fechado vapor de água e os gases
C5H12(g) + O2(g) → CO2(g) + H2O(g)
Atente para as seguintes afirmações referentes às relações dos volumes dos reagentes consumidos e dos produtos obtidos.
I. A relação entre os volumes de C5H12(g) consumido e de CO2(g) obtido é de 2:5.
II. A relação entre os volumes de O2(g) consumido e de CO2(g) obtido é de 8:5.
III. A relação entre os volumes de C5H12(g) consumido e de H2O(g) obtido é de 1:6.
É correto o que se afirma em
1. eletronegatividade; 2. energia de ionização; 3. afinidade eletrônica; 4. eletropositividade.
( ) Energia liberada quando um elétron adicional é acrescentado a um átomo no estado gasoso.
( ) Energia mínima necessária para remover um elétron de um átomo ou íon no estado gasoso.
( ) Tendência do átomo em doar elétrons durante as ligações químicas.
( ) Tendência que um átomo tem de atrair elétrons para si em uma ligação química em uma molécula isolada.
A sequência correta, de cima para baixo, é:
I. Na tabela periódica, o volume atômico dos elementos não varia periodicamente, ou seja, não varia em intervalos regulares.
II. A massa atômica dos elementos químicos varia periodicamente com o aumento ou diminuição do número atômico.
Considerando as proposições acima apresentadas, é correto afirmar que
Etapa 1: 2 NO(g)
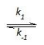 N2O2(g) (rápida, equilíbrio)
N2O2(g) (rápida, equilíbrio) Etapa 2: N2O2(g) + Br2(g)
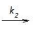 2NOBr (lenta)
2NOBr (lenta) A constante de velocidade para a reação entre óxido nítrico e bromo pode ser expresso em função das constantes k1, k-1 e k2 por meio da expressão:
Admitindo que não há reação química entre as substâncias, e que na mistura ocorra a aditividade das massas e dos volumes, a densidade do material confeccionado pode ser expressa como:
Observe a tabela a seguir, na qual uma propriedade periódica X é apresentada, com unidade de medida adequada, para três elementos químicos.
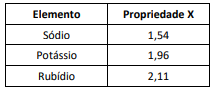
A propriedade representada por X é
Atualmente tais processos podem ser classificados como reações de
Para essas moléculas, as geometrias espaciais são, respectivamente,
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Além dos estados sólido, líquido e gasoso, há o plasma, que
é a condição da matéria associada a partículas muito
energizadas, com certo distanciamento e nenhuma ou pouca
ligação entre si, e cujas propriedades são semelhantes às do
estado líquido, mas com uma energia cinética maior.
Sobre esse fenômeno, analise as possíveis explicações abaixo sobre o caso:
1. O ponto de ebulição da água aumenta com a adição de sal, pois há um aumento da intensidade da força de coesão entre os íons do sal e as moléculas da água.
2. A adição do sal resulta em uma diminuição da temperatura de ebulição da água.
3. A pressão de vapor da água aumenta devido à atração das moléculas da água com os íons do sal, o que dificulta a evaporação.
4. O abaixamento da pressão de vapor, em soluções diluídas, é diretamente proporcional à concentração do soluto.
Assinale a alternativa que indica todas as afirmativas corretas.
Nesse caso, assinale a alternativa que indica corretamente o que deve ser realizado.