Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
Elementos Químicos Distribuição Eletrônica
I 1s2 2s2 2p6 3s23p3 II 1s2 2s2 2p6 3s2 3p6 4s2 3d8 III 1s2 2s2 2p6 3s2 3p6 4s2 IV 1s2 2s2 2p6 3s2 3p6 4s23d10 4p3 V 1s2 2s2 2p6 3s2 3p
De acordo com as informações localizadas na tabela acima, é correto afirmar que:
A tabela periódica dos elementos químicos relaciona os elementos em linhas (Períodos) e colunas (Grupos ou Famílias), dispostos em ordem crescente de seus números atômicos. As propriedades dos elementos químicos presentes no mesmo grupo são semelhantes. Neste contexto, considere os seguintes elementos químicos e seus respectivos números atômicos.
Césio (Cs) Z = 55
Enxofre (S) Z = 16
Argônio (Ar) Z = 18
Magnésio Mg) Z =12
A partir dessas informações assinale a
alternativa correta.
I. O átomo era uma esfera não maciça, contendo carga elétrica positiva e negativa distribuídas em harmonia. O átomo teria carga elétrica total nula. II. O átomo não seria maciço como proposto por estudos anteriores. Seria descontínuo, nucleado e composto por duas regiões (O núcleo e a eletrosfera). III. O átomo era uma partícula minúscula, maciça, esférica e indivisível, não podendo ser criado nem destruído. IV. As órbitas elípticas indicaram um segundo número quântico (número quântico secundário), explicando como os espectros de emissão de luz apresentavam o fenômeno de linhas múltiplas nas raias espectrais. V. Os elétrons não giram aleatoriamente ao redor do núcleo, mas se movimentam ao redor do núcleo, em órbitas circulares determinadas. E cada órbita circular de elétrons apresentava um nível de energia definida e constante.
( ) Modelo de Dalton; ( ) Modelo de Thomson; ( ) Modelo de Rutherford; ( ) Modelo de Bohr; ( ) Modelo de Sommerfeld.
Assinale a alternativa que apresenta a sequência correta que associa os modelos atômicos aos seus respectivos responsáveis
Adaptado. Oxigênio Hospitalar (mixandi.com.br). Acesso em 24 de Julho de 2021.
Considere a seguinte situação hipotética. Temos em um hospital, um cilindro contendo gás oxigênio hospitalar com volume de 15 m3 , mantido à temperatura de -23 ℃ e à pressão de 25 atm. Assinale a alternativa que apresenta a quantidade, em mols, e a massa, em quilogramas (Kg), de O2 que estão contidas neste cilindro. Considere o O2 um gás ideal. Dados: R = 0,082 atm.L.K-1 .mol-1 ; M.M do gás O2 (g/mol) = 32.
As reações abaixo representadas por I, II e III podem ser classificadas, respectivamente, como reações de:
I. N2O4(g) → 2 NO2(g)
II. 2 Cr(s) + 3 PbSO4(aq) → Cr2 (SO4 )3(aq) + 3 Pb(s)
III. 3 Ca(OH)2(aq) + Al2
(SO4
)3(s) → 2 Al(OH)3(aq) + 3 CaSO4(s)
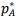 = 12 kPa e de B é
= 12 kPa e de B é 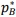 = 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta.
= 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta. Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
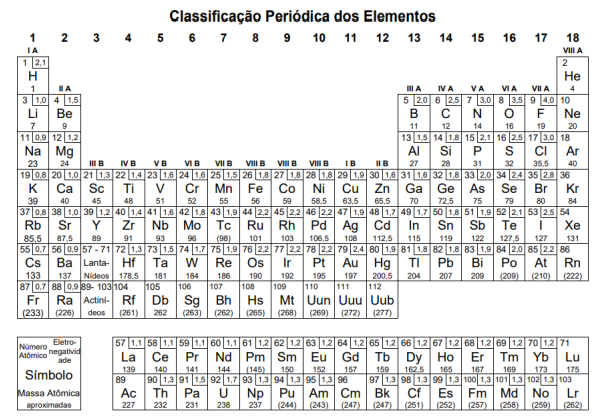
Sobre esses três elementos, avalie as seguintes afirmações:
I. Bário é um metal alcalino terroso.
II. Antimônio é o que possui maior raio atômico.
III. Chumbo possui quatro elétrons na sua camada de valência.
Está correto apenas o que se afirma em
No que tange à química geral e à inorgânica, julgue o item seguinte.
A reação de substituição ocorre quando duas substâncias
compostas trocam seus elementos, formando-se, assim,
novas substâncias.
No que tange à química geral e à inorgânica, julgue o item seguinte.
As reações químicas ocorrem sem a presença de fator
externo.
I. possuem baixos ponto de fusão, ponto de ebulição e densidade. II. reagem violentamente com água, gerando como produtos uma base e gás hidrogênio. III. perdem elétrons com facilidade, tendendo a formar íons monovalentes.
Possuem essas características os elementos químicos pertencentes ao grupo
A partir dessas novas leis foi possível determinar a(o)
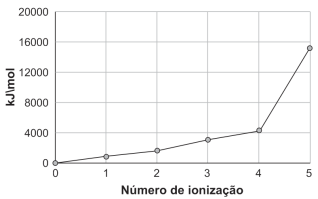
De acordo com as informações, o elemento X é o
Apenas uma pequena parte dos elementos da tabela periódica refere-se aos metais, por serem bons condutores de calor e eletricidade, diferentemente dos ametais, que apresentam má condução de eletricidade e calor. A União Internacional de Química Pura e Aplicada (IUPAC) reconhece o grupo de metaloides, distinguindo-os dos metais por causa de suas propriedades eletrônicas.
Durante os anos de 1800 a 1900, os cientistas da época notaram que muitos dos elementos químicos apresentavam propriedades semelhantes entre si. A observação da regularidade periódica das propriedades físicas e químicas dos elementos conhecidos, bem como a necessidade de organizar um grande volume de informações disponíveis, levaram ao desenvolvimento da tabela periódica.
Bohr postulou sobre a estrutura eletrônica de um átomo ao propor que a matéria é formada por átomos, partículas maciças e indivisíveis que não podem ser criadas nem destruídas. Nesse modelo, os átomos preservam sua identidade em todas as transformações, sendo impossível transformar um elemento químico em outro, o que se contrapõe às ideias dos alquimistas.