Questões de Concurso Público Petrobras 2011 para Técnico Químico de Petróleo Júnior
Foram encontradas 5 questões
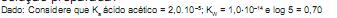
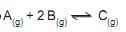 foi determinada em diferentes temperaturas, como mostra a tabela abaixo.
foi determinada em diferentes temperaturas, como mostra a tabela abaixo.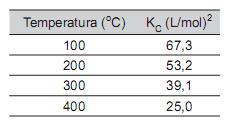
A esse respeito, considere as afirmativas a seguir
I - O aumento da temperatura aumenta a quantidade de produto formada.
II - Trata-se de uma reação com ΔH menor que zero.
III - O aumento da pressão aumenta a quantidade de produto formada.
IV - Na temperatura de 100 °C, o equilíbrio foi alcançado mais rapidamente que a 400 °C.
Estão corretas APENAS as afirmativas
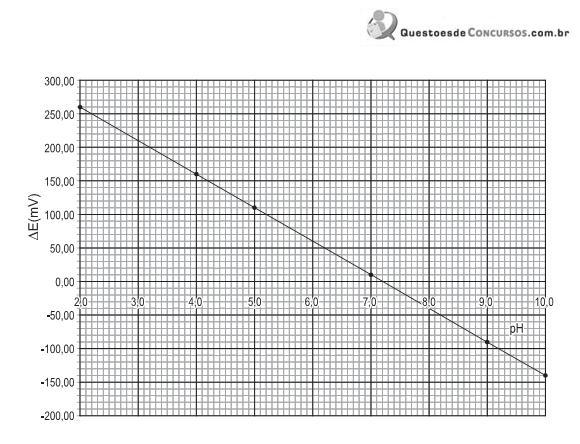
A partir da análise do gráfico, o módulo do fator de resposta, em mV/pH, é
Dado: pF = -log [F- ]
Sobre essa análise potenciométrica, afirma-se que o(a)
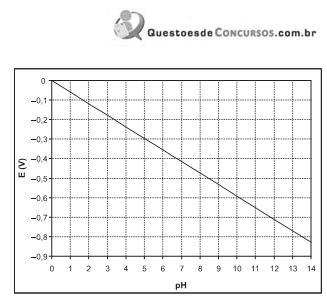
Sobre a transformação da água em gás hidrogênio, por um processo de oxidação/redução, considere as afirmativas abaixo.
I – O uso de qualquer agente oxidante provoca a liberação do gás hidrogênio, independente do valor do pH da solução.
II – Para pH igual a seis, a liberação de gás hidrogênio só será observada se o outro reagente apresentar potencial do eletrodo menor que, aproximadamente, – 0,35 V.
III – A liberação de gás hidrogênio em meio fortemente ácido só será observada se a espécie que irá reagir apresentar potencial do eletrodo positivo.
IV – Existem metais capazes de provocar a liberação de gás hidrogênio, mesmo com o valor de pH igual a 14.
Estão corretas APENAS as afirmativas