Questões de Concurso Público Petrobras 2018 para Engenheiro de Processamento Júnior
Foram encontradas 70 questões
A concentração da solução preparada, em mol L-1, corresponde a, aproximadamente,
Dado Massa molar do etanol: 46 g mol-1
Assumindo que o dióxido de carbono apresente comportamento de gás ideal, sua densidade, em kg m-3, nessas condições, é aproximadamente igual a
Dados Massa molar do dióxido de carbono: 44 g mol-1 Constante universal dos gases ideais: 8,31 Pa m3 mol-1 K-1
Nesse sistema, a pressão parcial do gás nitrogênio, em kPa, corresponde a
Admitindo-se que não há acúmulo, a vazão mássica da corrente com menor concentração de óleo, em kg h-1, corresponde aproximadamente a
Qual a concentração percentual de sal na corrente inicial?
Dados Massa molar do C3H8 : 44 g mol-1 Massa molar do O2 : 32 g mol-1
Sendo o rendimento da reação igual a 90%, a taxa de formação de CaCO3, em kg h-1 , corresponde a
Dados Massa molar do CO2 : 44 g mol-1 Massa molar do CaCO3 : 100 g mol-1
Nesse processo, o trabalho de expansão realizado pelo gás e a variação de energia interna do gás são, respectivamente, iguais a
Nessas condições, a quantidade de calor necessária, em kJ, para esse aquecimento é igual a
Qual a capacidade, em kW, de refrigeração desse ciclo frigorífico?
Tomando como base a Primeira e Segunda Leis da Termodinâmica, observe as afirmativas a seguir.
I - Para qualquer ciclo percorrido por um sistema, a integral cíclica do calor é proporcional à integral cíclica da energia interna do sistema. II - A energia interna é uma propriedade extensiva e representa a soma às energias cinética e potencial do sistema. III - Uma bomba de calor é um dispositivo que opera segundo um ciclo, que requer trabalho e que realiza o objetivo de transferir calor de um corpo de baixa temperatura para um corpo de alta temperatura.
Está correto APENAS o que afirma em
Nessas condições, qual a área, em m2, do pistão?
Dado Aceleração da gravidade = 10 m/s2
A água é uma substância essencial para a vida e pode se decompor em hidrogênio e oxigênio, como representado na equação abaixo, com a água na fase vapor.
H2O ⇔ 2H2 + O2
O valor de ∆G0 a 25°C é, aproximadamente,
Dado
Água (H2O)
h0f,298 = - 241 826 kJ/kmol
S0T,298 = 188,835 kJ/kmol
Hidrogênio (H2)
S0T,298 = 130,678 kJ/kmol
Oxigênio diatômico (O2)
S0T,298 = 205,148 kJ/kmol
Assumindo o ar como um gás ideal, o valor aproximado da temperatura de estagnação isentrópica, em kelvin, é
Dado Cp0 = 1,004 kJ/kg K
Lembrando que a equação fundamental da termodinâmica é dG = –sdT + VdP, a relação (∂s/∂P)T , para um gás cuja equação de estado é P(v – a) = RT, corresponde a
Nessas condições, o valor da constante de equilíbrio é, aproximadamente, de
Dado R = 8,3145 kJ/kmol.K
Dado K* = Cp / Cv = 1,4 (2)3,5 = 11,30
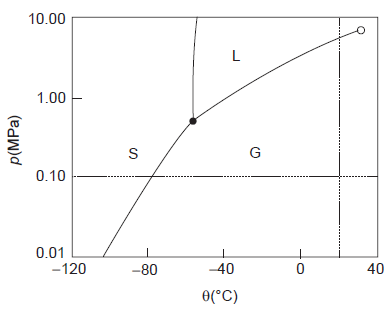
Em relação à substância, tem-se que o