Questões de Concurso Público SEDU-ES 2010 para Professor B — Ensino Fundamental e Médio — Química
Foram encontradas 120 questões
A assimilação é um processo cognitivo em que uma pessoa integra novo conhecimento, conceito, ideia, experiência ou dado perceptual aos esquemas ou padrões de comportamentos já existentes.
Segundo a teoria behaviorista, o com portamento é resultante da interação entre aquilo que o indivíduo faz e o ambiente onde o seu fazer acontece. A esse respeito, julgue o próximo item.
O uso do reforço positivo, na prática de ensino, é uma estratégia
adotada pelos professores para aumentar a probabilidade de o
aluno dar respostas de acordo com os objetivos esperados.
No sistema de ensino, a prática de compartimentalização do saber e da inteligência e a visão reducionista das coisas rompem com a complexidade do mundo. A cerca desse assunto, julgue o próximo item.
A educação deve favorecer a aptidão natural da mente em
formular e resolver problemas essenciais e deve estimular o uso
da inteligência geral, predominante no período da infância e
extinta na adolescência em razão do aprendizado dos princípios
reducionistas das coisas.
A avaliação diagnostica é utilizada para identificar as patologias que impedem a criança de aprender na escola.
A atribuição de notas é preponderante na avaliação formativa.
Defesas de projetos, dissertações e teses são instrumentos válidos de avaliação.
A avaliação deve acontecer sempre ao final do conteúdo ministrado para que o professor possa descobrir o que o aluno não aprendeu.
Provas orais ou escritas, questionários e redações são instrumentos da avaliação formal. Os juízos de valor emitidos pelo professor sobre as competências dos alunos fazem parte do plano da avaliação informal.
A LDB prevê a avaliação do aluno pelo professor, assim como a avaliação do sistema educacional.
A LDB recomenda que o professor escolha, logo no início do ano, o tipo de avaliação que utilizará ao final do conteúdo ministrado, pois, assim, garantirá a segurança dos resultados alcançados.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
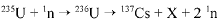
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
O isótopo X da reação apresentada consiste em um átomo de 98Sr.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
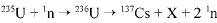
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
A radiação beta possui maior poder de penetração que a
radiação gama.
O bombardeamento do urânio-235 com nêutrons induz a um a série de reações de fissão nuclear altamente energéticas. Em uma dessas reações, após a captura de um nêutron (1n), o urânio se desintegra para formar um átomo de césio-137, um isótopo X, e dois outros nêutrons capazes de gerar uma reação em cadeia:
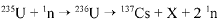
O césio-137 assim formado é um isótopo radioativo que emite radiações gama e beta e pode ser em pregado em radioterapia com o intuito de destruir células cancerosas.
A partir do texto acima e considerando que o tempo de m eia-vida do césio-137 é de 30 anos, julgue o item que se segue.
Mesmo após um período de 300 anos, mais de 1% dos átomos
de césio-137 deverão estar ativos.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
De acordo com os dados fornecidos no rótulo do frasco, a
concentração da solução estoque de NH4OH é superior a 7,0
mol/L.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O volume de solução estoque em pregada para a preparação da
solução desejada foi superior a 8,0 mL.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O indicador ácido-base mais apropriado para a detecção do
ponto final da titulação deve apresentar a faixa de viragem em
pH ácido.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 -5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A 25 °C, a porcentagem de dissociação do NH4OH em uma
solução 0,10 mol/L é superior a 1 %.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
Em uma solução de NH4OH, a 25 °C, o produto das atividades
dos íons hidrônio e dos íons hidróxido é maior que 1,0 x 10-14
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A molécula de NH3 é apoiar e apresenta geometria trigonal
plana.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
Se o volume da solução de HC1 gasto quando atingido o ponto
de equivalência na titulação for igual a 21,0 mL, a concentração
da solução de NH4OH preparada é menor que o 0,10 mol/L
pretendido.