Questões de Concurso Público UFRJ 2014 para Técnico em Química
Foram encontradas 29 questões

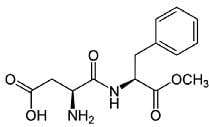
Dados que as concentrações iniciais do CH 3 COOH CH3COO– são iguais e valem 0,125 mol/L, o pKa = 4,75, e que log 0,98 = -0,007, pode-se afirmar que:

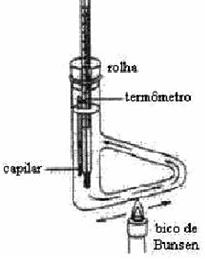
Levando em consideração os algarismos significativos, o volume correto lido da proveta é:
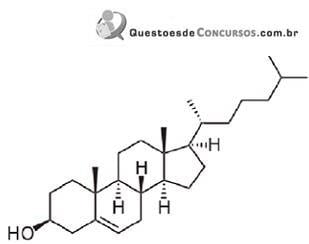
Baseado nessas informações, é INCORRETO afirmar que:
(1) 40 mL de uma solução de NaOH foi totalmente neutralizada com 16 mL de uma solução de HCl.
(2) Depois, 55 mL de NaOH foram adicionados a uma quantidade de matéria de 0,046 mols de ácido acético.
(3) O excesso de NaOH da etapa 2 foi titulada com uma solução de HCl e foram gastos 8,25 mL do ácido até o ponto de equivalência.
Com base nessas anotações, o volume de NaOH necessário para neutralizar 0,046 mols de CH3COOH é de:
Indicadores ácido-base Cor e pH
fenolftaleína Incolor em pH ≤ 8,3
Rosa-claro em pH entre 8,3 e 10,0
Vermelho em pH ≥ 10,0
Azul de bromotimol amarelo em pH ≤ 6
azul em pH ≥ 7,6
verde em pH entre 6,0 e 7,6
Alaranjado de metila vermelho em pH ≤ 3,1
alaranjado em pH entre 3,1 e 4,4
amarelo em pH ≥ 4,4
A amostra da água da chuva em contato com a solução de: