Questões de Concurso Público FURG 2019 para Técnico em Química
Foram encontradas 23 questões
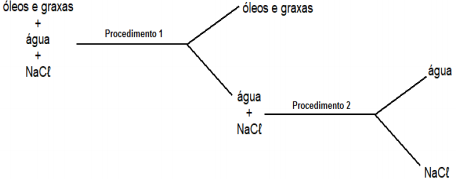
Sabendo que água e “óleos e graxas” são imiscíveis e o NaCℓ não é solúvel em “óleos e graxas”, assinale a alternativa que apresenta, na ordem, os dois procedimentos mais viáveis para separar uma mistura formada pelas três substâncias, segundo o esquema abaixo:
Deseja-se preparar 250 mL de solução estoque de sulfato de amônio, com concentração de 10.000 µM de N-NH4+ , para tanto, deve-se pesar:
Dados: Massas atômicas (g mol-1) N= 14,01; H= 1,01; S= 32,07 e O= 16,00.
Considere a reação abaixo e as afirmativas sobre ela, a seguir.
KMnO4 + H2SO4 + H2O2 → K2SO4 + MnSO4 + H2O + O2
I. A sequência correta dos coeficientes estequiométricos de cada uma das substâncias, na ordem em que elas aparecem na reação acima, é 2; 3; 5; 1; 2; 8; 5.
II. O KMnO4 se oxida e o H2O2 se reduz.
III. O KMnO4 ganha 5 elétrons e a H2O2 perde 2 elétrons.
IV. O KMnO4 é o agente oxidante e a H2O2 é o agente redutor.
V. A soma da carga dos reagentes é diferente da soma das cargas dos produtos.
Assinale a alternativa que apresenta a(s) afirmativa(s) correta(s).
A legislação ambiental de certos estados brasileiros não permite o lançamento em ambientes aquáticos de efluentes com pH inferior a 5,0 ou superior a 9,0. No que se refere à acidez, os efluentes líquidos das Indústrias A, B e C apresentam as seguintes concentrações:
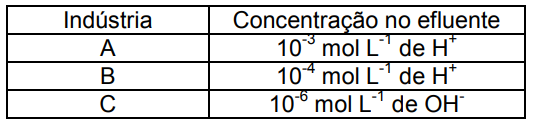
Considerando o quadro acima, poderiam ser lançados em ambientes aquáticos, sem tratamento, apenas os efluentes da(s) Indústria(s):
Em relação ao uso e aferição das figuras abaixo, marque V para as alternativas verdadeiras e F para as falsas.
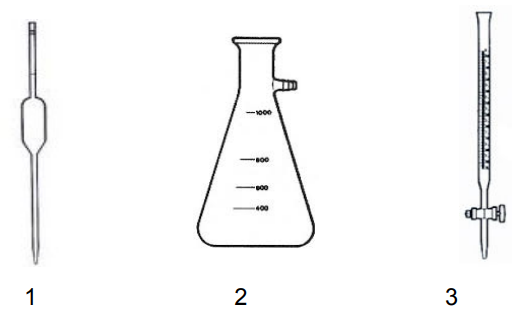
( ) A pipeta volumétrica (figura 1) é um instrumento que permite a medição a transferência de volumes variáveis de líquidos.
( ) A figura 3 é uma bureta, que é um instrumento cilíndrico, de vidro, colocado na vertical com a ajuda de um suporte universal, contendo uma escala graduada rigorosa, geralmente em mL.
( ) A figura 2 é um erlenmeyer, um instrumento ideal para armazenar e misturar soluções, fazer cultivo de organismos e tecidos e é predominantemente usado em titulações.
( ) A aferição de uma pipeta volumétrica (figura 1) é feita por meio da pesagem da água que dela é escoada e o tempo de escoamento necessita ser considerado.
( ) Antes do uso da bureta (figura 3), é necessário ambientá-las com a própria solução que irá analisar, a fim de evitar o risco de contaminação com vestígios de outras soluções que ainda possam estar impregnadas nas paredes internas.
Assinale a alternativa que apresenta a sequência correta, quando lida de cima para baixo.
A descarga de água subterrânea (Submarine Groundwater Discharge – SGD) tem sido considerada um importante elo entre o continente e o oceano, pois, além de carrear uma parcela considerável de água doce, a SGD é uma importante fonte de elementos para a zona costeira. Traçadores geoquímicos naturais, como o rádio (Ra), tem sido considerados uma excelente ferramenta para estudos que envolvam esse processo, pois, além das águas subterrâneas serem enriquecidas por esse elemento, este apresenta comportamento conservativo e suas constantes de decaimento permitem relações que possibilitam a estimativa dos fluxos subterrâneos. Os isótopos do rádio (223Ra, 224Ra, 226Ra e 228Ra) possuem tempos de meia-vida, respectivamente, iguais a:
Dados: Constantes de decaimento 223Ra= 0,06 dias-1; 224Ra= 0,19 dias-1; 226Ra= 0,43 10-3 anos-1 e 228Ra= 0,12 anos-1 .
Fórmula: λ = 0,693 / t½
Em que:
λ = Constante de decaimento
t½ = Tempo de meia-vida
Em uma amostra contendo 1 L de água do mar, dissolvem-se 35 g de sacarose. Em relação à consequência desse acréscimo de sacarose, são feitas as seguintes afirmações:
I. A pressão de vapor da água diminui.
II. A pressão osmótica da solução aumenta.
III. A salinidade permanece praticamente a mesma.
IV. A temperatura de solidificação é alterada.
V. O grau de dissociação dos sais presentes na água permanecerá praticamente o mesmo.
Das afirmações acima, estão corretas:
A Resolução n.º 357, do Conselho Nacional do Meio Ambiente (CONAMA, 2005), dispõe sobre a classificação dos corpos de água e diretrizes ambientais para o seu enquadramento, bem como estabelece as condições e padrões de lançamento de efluentes, e dá outras providências. O quadro a seguir, para as águas salobras de Classe 1, indica alguns dos parâmetros inorgânicos e suas concentrações máximas.
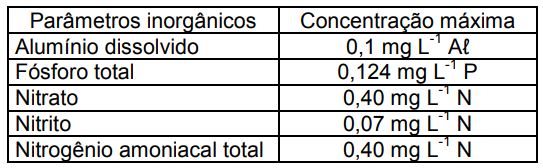
Transformando a unidade do nitrato para µM de N-NO3- e do nitrogênio amoniacal total para µM de N-NH4+ , as concentrações obtidas para a tabela acima são, respectivamente:
Dado: Massa atômica (g mol-1) N= 14,01; O= 16,00 e H=
1,01.
Quanto à determinação do pH com o uso de eletrodo de vidro combinado, são feitas as seguintes afirmativas:
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio.
II. O eletrodo de referência gera uma tensão elétrica constante que não depende do pH.
III. O eletrodo de referência é constituído de um material inerte (vidro). A membrana desse eletrodo, que tem geralmente a forma de um bulbo, é feita a partir de um vidro especial.
IV. Os eletrodos são construídos com metais inertes, tais como: platina, ouro, paládio.
V. Em soluções com valores de pH abaixo de 0,5, o eletrodo de vidro típico exibe um erro de sinal oposto ao do erro alcalino.
Assinale a alternativa que apresenta a(s) afirmativa(s) INCORRETA(S).
São apresentadas proposições a respeito das técnicas de espectrometria atômica e molecular:
I. A lâmpada de cátodo oco é empregada nas espectrometrias de absorção atômica e de emissão atômica.
II. As cubetas de quartzo empregadas na espectrofotometria UV/VIS são as mais adequadas para análises quando λ > 390 nm.
III. Uma lâmpada de tungstênio (W) é a fonte de radiação contínua mais comum para a região do visível na espectrofotometria.
IV. Por ser uma técnica espectrométrica, o princípio da espectrometria de emissão atômica em chama (ou fotometria de chama) está baseado na lei de BeerLambert.
V. A lâmpada de deutério (2H) é comumente utilizada como corretor de fundo na análise espectrométrica de absorção atômica.
Assinale a alternativa correta: