Questões de Concurso
Foram encontradas 2.201 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Observe a tabela a seguir.
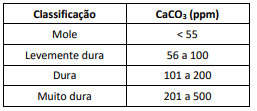
A análise de 120,0g de uma amostra de água de um manancial indicou a presença de 15,0mg de CaCO3. Essa amostra deve classificada como
• Porcentagem em massa: 70 % m/m
• Massa molar: 63 g/mol
• Densidade: 1,4 g/mL
Qual o valor da concentração da solução de ácido nítrico, em mol/L, preparada pelo químico?
Cr2 O72– (aq) + 6 Fe2+ (aq) + 14 H+ (aq) ⇌ 6 Fe3+ (aq) + 2 Cr3+ (aq) + 7 H2O
Com base na reação global dessa titulação, qual o valor mais próximo do percentual de ferro em massa no comprimido?
4 Au(minério) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 Na[Au(CN)2](aq) + 4 NaOH(aq)
A espécie química solúvel [Au(CN)2]− é posteriormente imobilizada sobre carvão ativado, e o ouro é recuperado por redução eletroquímica:
[Au(CN)2]−(aq) + e− → Au(s) + 2 CN−(aq)
Dados: Massa molar (g mol−1): Au = 197, NaCN = 49.
Considerando a estequiometria das reações, qual é a massa de ouro que se espera extrair, utilizando-se 1 kg de cianeto de sódio?
H2PO3F(aq) + 2 NaOH(aq) → Na2PO3F(aq) + 2 H2O(l)
Adicionou-se uma solução de NaOH 0,14 mol L-1 ao ácido até ser obtido 0,28 mol de Na2PO3F. Qual foi o volume da solução de NaOH adicionado?