Questões de Concurso
Foram encontradas 991 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!

Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1, 2 ou 3) representa a variação de entalpia da n-ésima etapa:

A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
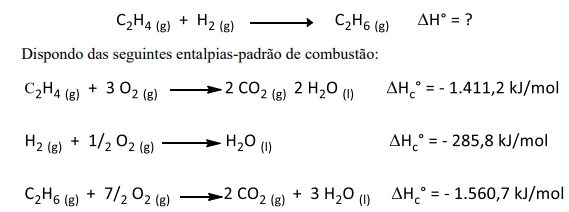
O ΔH° para a reação em questão, em kJ/mol, será igual a:
Atenção: Para responder à questão, considere as informações abaixo.
As baleias são os maiores seres vivos do planeta e importantes recicladores de nutrientes dos oceanos. Elas consomem uma quantidade colossal de alimento e suas fezes fertilizam as águas próximas à superfície. Por exemplo, uma baleia azul come cerca de 16 toneladas de peixes, lulas e pequenos crustáceos por dia. Hoje, apenas no oceano Austral, as baleias reciclam por ano, 1 200 toneladas de ferro, nutriente essencial para a reprodução do plâncton, organismos microscópicos que estão na base da cadeia alimentar marinha e contribuem para captar gás carbônico da atmosfera.
(Adaptado de: Revista Pesquisa Fapesp, dez. 2021)
Considerando que o ferro reciclado pelas baleias no oceano Austral anualmente esteja na forma de íons Fe3+ , a massa de íons cloreto necessária para neutralizar toda sua carga elétrica é, em toneladas, de, aproximadamente:
Dados:
Massas molares (g/mol)
Cℓ = 35,5;
Fe = 55,8
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.