Questões de Concurso
Foram encontradas 2.585 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um dos radionuclídeos do Radônio é 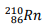 que decai emitindo
partículas alfa (α) para um dos isótopos do Polônio.
que decai emitindo
partículas alfa (α) para um dos isótopos do Polônio.
Uma reação que representa esse processo de desintegração nuclear é dada por:
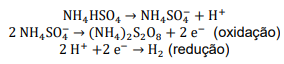
A hidrólise do persulfato de amônio forma H2O2:
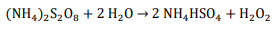
Se a eficiência do processo eletrolítico é de 60% assinale a opção que mostra a INTENSIDADE DE CORRENTE necessária para produzir 97 g de H2O2 por hora: Dados eventualmente necessários: constante de Faraday = 96500 C/mol; massas molares (g/mol): N = 14; O = 16; H = 1; S = 32.
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
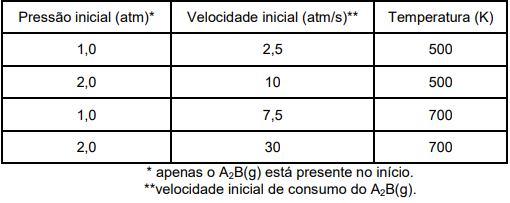
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Figura: Dados cinéticos para uma reação de primeira ordem. Concentração versus tempo e velocidade versus tempo.
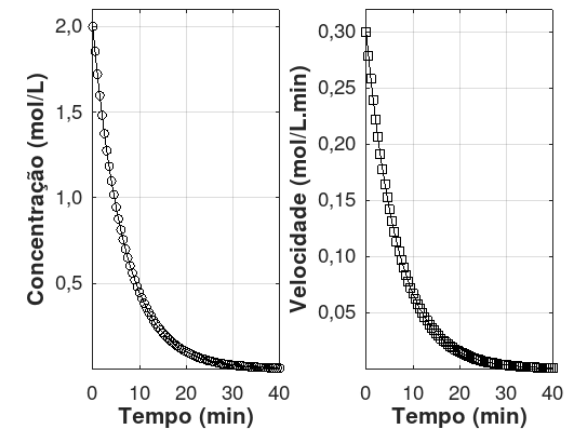
A partir da interpretação dos gráficos mostrados acima, assinale a opção que mostra corretamente O VALOR DO TEMPO DE MEIA-VIDA do processo, em minutos, com precisão de duas casas decimais: Dado: considere ln(2) = 0,693.
H0 = pKa(BH+) - log [BH+] / [B]
onde B é um indicador básico, BH+ é o ácido conjugado desse indicador e pKa(BH+) é a constante de acidez deste último. Quando o indicador é nitroanilina (C6H6N2O2), experimentos realizados para ácidos puros nas mesmas condições, permitem construir a tabela abaixo:
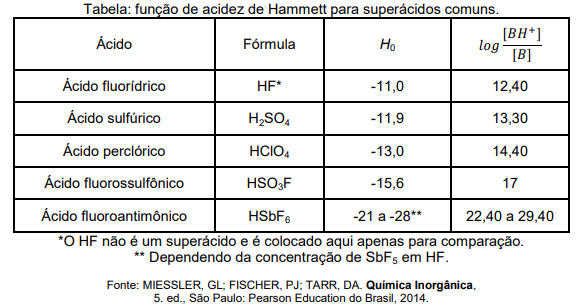
Diante dessas informações, assinale a opção que mostra a ÚNICA reação termodinamicamente espontânea entre pares das substâncias citadas acima: