Questões de Concurso Comentadas por alunos sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 138 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
NH3(g) ⇔
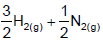
O valor correspondente de Kc (T) para essa reação no estado padrão de 1 mol L-1 é de
Dado Constante dos gases, R=0,083145 L.bar.mol-1 .K-1
O gráfico a seguir representa o inverso da velocidade de reação em função da conversão, para análise da disposição mais adequada de dois reatores de mistura completa, em série e com volumes diferentes.

Tendo como referência esse gráfico, julgue o próximo item, a respeito de reatores químicos.
Se o processo reativo em questão acontecesse em dois
reatores em série de mistura completa (CSTR, completely
stirred tank reactor), para uma ordem de reação acima da
unidade, a configuração mais adequada e, portanto, com
menor volume total, corresponde, primeiramente, ao reator
de maior volume, seguido do reator de menor volume.
O gráfico a seguir representa o inverso da velocidade de reação em função da conversão, para análise da disposição mais adequada de dois reatores de mistura completa, em série e com volumes diferentes.

Tendo como referência esse gráfico, julgue o próximo item, a respeito de reatores químicos.
Para sistemas que operem nas mesmas condições de
alimentação, se os reatores têm igual volume em operação
isoterma, na ocorrência de uma reação A→P de primeira
ordem, a conversão obtida com um sistema de fluxo
empistonado é maior que com um sistema reacional de
mistura perfeita.
Com relação aos processos termodinâmicos que envolvem liberação e aproveitamento de energia, julgue o item que se segue.
Um processo reativo A→B, que apresenta um decaimento da
concentração do reagente A ajustável a um polinômio de
primeiro grau obedece a uma cinética de primeira ordem.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 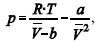 julgue o item que segue.
julgue o item que segue.
A partir do gráfico apresentado, conclui-se que o CO2 (g)
apresenta a constante b na equação de van der Waals inferior
à do O2 (g).