Questões de Concurso
Foram encontradas 13.432 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Quanto às especificações a respeito dos processos de inscrição definitiva e provisória determinados na Resolução CFF nº 521/09, julgue as afirmativas verdadeiras (V) ou falsas (F).
( ) Será efetivada a inscrição, provisória ou definitiva, no Quadro de Farmacêuticos do Conselho Regional de Farmácia, do egresso da Instituição de Ensino Superior que atendeu aos requisitos da Lei nº 3.820/60 e dessa Resolução.
( ) Autuado e numerado o processo com as taxas devidamente pagas, será encaminhado para um Conselheiro Relator e, posteriormente, apresentado na primeira reunião plenária do Conselho Regional.
( ) Caracterizada a necessidade ou o interesse público, o Presidente do Conselho Regional poderá, “ad referendum” do Plenário do CRF, deferir o pedido, fundamentando sua decisão, devendo submetê-la na reunião subsequente para a devida apreciação, seguindo as regras previstas no regimento interno padrão.
( ) A decisão do Plenário do Conselho Regional será comunicada ao interessado por via postal, com aviso de recebimento.
( ) Para o processo de inscrição serão anexadas fotocópias dos documentos apresentados na entrega do requerimento, devendo o funcionário responsável pelo recebimento dos mesmos atestar, por escrito, que as fotocópias conferem com os originais, apondo carimbo com os dizeres “confere com o original” sob a rubrica.
Assinale a alternativa com a sequência correta.
Conforme estabelece a Resolução CFF nº 521/09, no caso em que o interessado tenha de exercer provisoriamente, por no máximo 90 dias, a profissão em outra jurisdição, apresentará sua carteira profissional para ser visada pelo Presidente do respectivo Conselho Regional de destino. O Conselho Regional de Farmácia de destino solicitará ao Conselho Regional de Farmácia de origem certidão constando:
I. quitação de todas as taxas e emolumentos, bem como anuidades e multas;
II. se o profissional possui processo ético em andamento, sendo que, após o trânsito em julgado, o CRF de origem deverá informar o arquivamento ou penalidade imposta, a qual deverá ser aplicada pelo CRF de destino;
III. que o farmacêutico não possui responsabilidade técnica;
IV. proibições, impedimentos e penalidades não prescritas.
Pode-se afirmar que:
A tabela abaixo demonstra o valor (em Reais) recebido por uma farmácia em um dia.
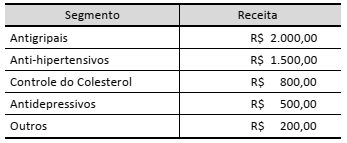
Com base nesses dados, pode-se afirmar que:
A Deliberação do CRF/AL: 03/2016 (publicada no DOU nº 87 em 09/05/16) dispõe sobre o registro de Posto de Medicamentos no Conselho Regional de Farmácia do Estado de Alagoas e dá outras providências. Considerando a necessidade de estabelecer critérios mínimos para o registro de Postos de Medicamentos no Conselho Regional de Farmácia do Estado de Alagoas, analise as afirmativas seguintes.
I. Somente será permitido o registro de Posto de medicamentos em localidades em que: não exista farmácia ou drogaria registrada; a farmácia ou drogaria registrada esteja distante, no mínimo, 3 (três) Km da localidade.
II. Instituir novo Requerimento de Registro de Posto de Medicamento, conforme Anexo I desta Deliberação, com firma reconhecida em Cartório, no qual o proprietário declara estar ciente de que, caso seja instalada farmácia ou drogaria na localidade, deverá promover imediatamente a contratação de farmacêutico e a consequente homologação da Responsabilidade Técnica junto ao CRF/AL e autoridades sanitárias.
III. Instituir a Declaração do Farmacêutico, conforme Anexo II desta Deliberação, com firma reconhecida em Cartório, na qual o farmacêutico, nos termos do art. 154 da Lei Estadual nº 4.406/82, declara que o proprietário do Posto de Medicamentos é pessoa idônea e possui capacidade necessária à dispensação dos produtos farmacêuticos. Serão exigidas Declarações de 1 (um) farmacêutico regular com inscrição definitiva e em pleno gozo de suas prerrogativas legais para cada estabelecimento requerente.
IV. Somente serão aceitas Declarações de Farmacêuticos que: possuam inscrição Definitiva há pelo menos 2 (dois) anos; estejam com sua anuidade em dia; não estejam respondendo ou tenham respondido a processo ético-disciplinar nos últimos 5 (cinco) anos; possuam Perfil de Assistência Farmacêutica tipo 01 (presença em pelo menos 70% das inspeções realizadas no seu horário de assistência farmacêutica – Resolução 579/13 do CFF).
V. Os interessados no registro de Posto de Medicamentos deverão apresentar: certificado ou declaração de conclusão do ensino médio com fotocópia autenticada; comprovação de experiência mínima de 1 (um) ano em farmácias ou drogarias, com registro na Carteira de Trabalho e Previdência Social (CTPS).
Está correto o que se afirma somente em:
A Lei nº 5.991/73 dispõe sobre o controle sanitário do comércio de drogas, medicamentos, insumos farmacêuticos e correlatos, e dá outras providências. Faça a correlação entre os itens e os conceitos apresentados.
I. Drogas.
II. Medicamentos.
III. Insumos Farmacêuticos.
IV. Correlatos.
( ) Produtos farmacêuticos, tecnicamente obtidos ou elaborados, com finalidade profilática, curativa, paliativa ou para fins de diagnósticos.
( ) Aparelhos, materiais ou acessórios cujo uso ou aplicação esteja ligado à defesa e proteção da saúde individual ou coletiva, à higiene pessoal ou de ambientes, ou afins diagnósticos e analíticos, ou, ainda, os cosméticos e os perfumes, os produtos dietéticos, óticos, de acústica médica, odontológicos e veterinários.
( ) Drogas ou matérias-primas aditivas ou complementares de qualquer natureza, destinadas a emprego em medicamentos, quando for o caso, e seus recipientes.
( ) Substâncias ou matérias-primas que tenham finalidade medicamentosa ou sanitária.
Assinale a alternativa com a correta e respectiva correlação quanto aos conceitos.
A Lei nº 9.787/99 altera a Lei nº 6.360, de 23 de setembro de 1976, que dispõe sobre a vigilância sanitária, estabelece o medicamento genérico, dispõe sobre a utilização de nomes genéricos em produtos farmacêuticos e dá outras providências. Faça a correlação entre os itens enumerados de I a V e as definições apresentadas.
I. Medicamento Similar.
II. Medicamento Genérico.
III. Medicamento de Referência.
IV. Bioequivalência.
V. Biodisponibilidade.
( ) Produto inovador registrado no órgão federal responsável pela vigilância sanitária e comercializado no País, cuja eficácia, segurança e qualidade foram comprovadas cientificamente junto ao órgão federal competente, por ocasião do registro.
( ) Medicamento similar a um produto de referência ou inovador, que se pretende ser com este intercambiável, geralmente produzido após a expiração ou renúncia da proteção patentária ou de outros direitos de exclusividade, comprovada a sua eficácia, segurança e qualidade, e designado pela DCB ou, na sua ausência, pela DCI.
( ) Aquele que contém o mesmo ou os mesmos princípios ativos, apresenta a mesma concentração, forma farmacêutica, via de administração, posologia e indicação terapêutica, preventiva ou diagnóstica, do medicamento de referência registrado no órgão federal responsável pela vigilância sanitária, podendo diferir somente em características relativas ao tamanho e à forma do produto, prazo de validade, embalagem, rotulagem, excipientes e veículos, devendo sempre ser identificado por nome comercial ou marca.
( ) Indica a velocidade e a extensão de absorção de um princípio ativo em uma forma de dosagem, a partir de sua curva concentração/tempo na circulação sistêmica ou sua excreção na urina."
( ) Consiste na demonstração de equivalência farmacêutica entre produtos apresentados sob a mesma forma farmacêutica, contendo idêntica composição qualitativa e quantitativa de princípio(s) ativo(s), e que tenham comparável biodisponibilidade, quando estudados sob um mesmo desenho experimental.
Assinale a alternativa com a correta e respectiva correlação quanto às definições.
Que diretriz da Portaria nº 3.916/98 trata dos temas descritos a seguir?
I. Obrigatoriedade da adoção da denominação genérica nos editais, propostas, contratos e notas fiscais.
II. Obrigatoriedade da adoção da denominação genérica nas compras e licitações públicas de medicamentos realizadas pela administração pública.
III. Ações de vigilância sanitária serão gradualmente descentralizadas.
IV. Promoção do uso de medicamentos genéricos.
V. Restrições e eliminações de produtos que venham a revelar-se inadequados ao uso, em conformidade com informações decorrentes da farmacovigilância.