Questões de Concurso Comentadas para ufrn
Foram encontradas 1.052 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Um dado importante para avaliar a qualidade da água é a determinação do índice de dureza da água, que corresponde à presença dos íons Ca2+ e Mg2+. As equações envolvidas para essa avaliação são as seguintes:
Ca2+ + H2Y2- ⇋ CaY2- + 2H+
Ca2+ + MgY2- ⇋ CaY2- + Mg2+
Mg2+ + HIn2- ⇋ MgIn- + H+
MgIn- + H2Y2- ⇋ MgY2- + HIn2- + H+
O técnico do laboratório recebeu e protocolou uma amostra de água para análise de dureza. O volume da amostra utilizado na titulação foi de 100,0 mL, e o volume de solução de EDTA 0,0100 mol L-1 gasto na titulação foi de 25,0 mL. Considere o resultado expresso em mg de CaCO3 por 1000 mL e a classificação da dureza da água, presentes na tabela abaixo.

Com base nas equações e na tabela, essa amostra é classificada como água
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s) 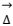 Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é