Questões de Concurso Para ufpi
Foram encontradas 1.649 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
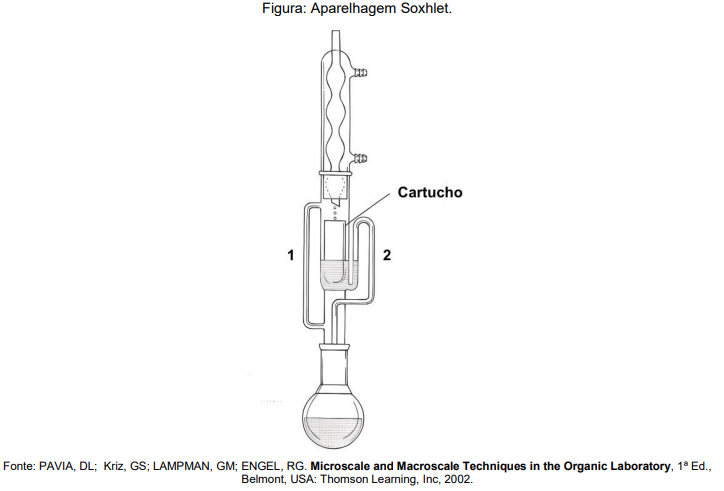
A respeito da aparelhagem mostrada e da técnica de extração com Soxhlet, assinale a opção CORRETA:
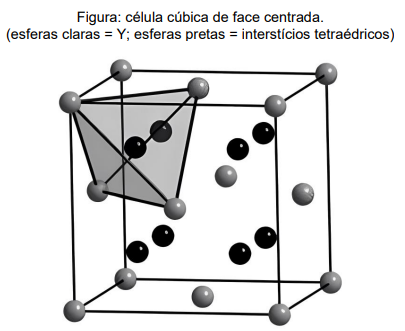
Sabe-se que, na célula apresentada, 1/8 (um oitavo) dos elementos nos vértices contribuem efetivamente para o retículo, enquanto os elementos nas faces contribuem com 1/2 (um meio). Diante das informações citadas, assinale a opção que mostra o número de INTERSTÍCIOS TETRAÉDRICOS, na célula cúbica mostrada, OCUPADOS PELO ELEMENTO X:
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
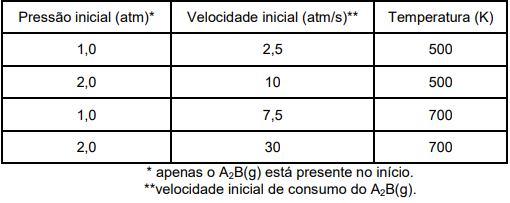
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Diante das informações e a partir dos seus conhecimentos, assinale a opção que mostra aproximadamente O VALOR DO pOH de uma solução de pH 8,50, a 37 °C:
Dados: densidade da água = 1000 g/L; massa molar da água = 18 g/mol; log(1,73) = 0,24; log(3) = 0,48.