Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A palavra “cujas”, nesse contexto linguístico,
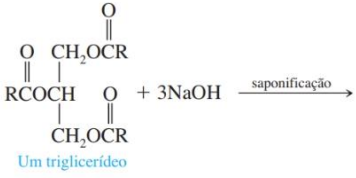
Coluna 1
1. Experimentos ilustrativos.
2. Demonstrações práticas.
3. Experimentos investigativos.
4. Experimentos descritivos.
Coluna 2
( ) Atividades realizadas pelo professor. Possibilitam ao aluno maior contato com os fenômenos já́ conhecidos e com equipamentos, instrumentos, fenômenos e até seres vivos.
( ) Atividades que os alunos podem realizar e que cumprem as mesmas finalidades das demonstrações práticas.
( ) Atividades que o aluno realiza e que não são obrigatoriamente dirigidas o tempo todo pelo professor. Nelas, o aluno tem contato direto com coisas ou fenômenos que precisa apurar, sejam comuns ou não ao seu dia a dia. Aproximam-se das atividades investigativas, porém não implicam a realização de testes de hipóteses.
( ) Atividades práticas que exigem participação ativa do aluno durante sua execução. Diferem das outras por envolverem obrigatoriamente discussão de ideias, elaboração de hipóteses investigativas e experimentos para testá-las.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
C5H11OH + O2 → CO2 + H2O
Com base nessa equação, assinale a alternativa correta.
( ) A teoria dos orbitais moleculares é a que melhor descreve a ligação química, pois resolve as deficiências da Teoria de Lewis e é mais simples na utilização dos cálculos quando comparada à Teoria de Valência.
( ) Nas ligações múltiplas, um átomo forma uma ligação “sigma” usando um orbital híbrido (sp ou sp2 ) e uma ou mais ligações “pi” usando orbitais não hibridados. A superposição lateral que produz uma ligação “pi” não restringe a rotação das moléculas, resultando em ligações mais fracas do que as ligações “sigma”, não impedindo que átomos maiores formem ligações múltiplas.
( ) Os diagramas de níveis de energia de orbitais moleculares de moléculas diatômicas heteronucleares são fáceis de predizer qualitativamente. Entretanto, são dificilmente calculados usando softwares específicos disponíveis.
( ) Na Teoria dos Orbitais Moleculares, todos os elétrons de valência estão deslocalizados sobre toda a molécula, isto é, não pertencem a alguma ligação específica.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
( ) A variação de entalpia (ΔH) de um sistema informa a quantidade de calor trocado por esse sistema à pressão constante. O sinal de ΔH informa se o processo é exotérmico ΔH>0 ou endotérmico ΔH<0.
( ) A representação de uma equação termoquímica deve incluir os coeficientes estequiométricos de todos os participantes e o ΔH do processo.
( ) A entalpia padrão de formação (ΔH0f) é positiva para as substâncias simples, desde que estejam no estado-padrão, no estado físico e na variedade alotrópica mais estável.
( ) Os valores ∆H são numericamente iguais, mas de sinais opostos, para reações químicas que sejam o inverso uma da outra.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
( ) Os monossacarídeos que contêm um grupo aldeído são classificados como aldoses, enquanto aqueles que apresentam um grupo cetona são classificados como cetoses.
( ) Sacarose e lactose são exemplos de monossacarídeos.
( ) Três polissacarídeos importantes, todos constituídos de unidades de glicose, são o amido, o glicogênio e a maltose.
( ) A celulose é um dissacarídeo amplamente distribuído nas estruturas de sustentação das plantas.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
I. O ácido carbônico é um ácido forte que sofre decomposição em gás carbônico e água.
II. Dióxido de carbono e trióxido de enxofre são exemplos de óxidos ácidos.
III. Monóxido de carbono e monóxido de nitrogênio são exemplos de óxidos neutros.
IV. Mg(OH)2 e Al(OH)3 são bases comumente empregadas como antiácidos estomacais.
V. Al2O3 é um exemplo de óxido básico.
Quais estão corretas?
Coluna 1
1. Avaliação formativa.
2. Avaliação diagnóstica.
3. Avaliação de controle.
4. Avaliação classificatória.
Coluna 2
( ) Visa criar um ranking de aproveitamento, sendo eminentemente comparativa.
( ) Objetiva analisar o ponto de partida, ou seja, os conhecimentos prévios do aluno, ou os conteúdos e métodos que o professor domina.
( ) Ocorre durante o processo, objetivando corrigir os caminhos tomados, principalmente no que tange ao método de ensino.
( ) Analisa o conjunto para saber se o objetivo educacional foi alcançado.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
( ) Em 1913, Bohr propôs um modelo no qual os elétrons orbitam o núcleo, porém com uma órbita definida e particular. Bohr conhecia os trabalhos de Planck e Einstein. Em seu modelo, os elétrons ocupam estados estacionários de energia fixa. Os elétrons podem realizar saltos quânticos de um estado de energia para outro em que é liberado um fóton.
( ) O físico inglês J. J. Thomson usou o tubo de raios catódicos e seu conhecimento da teoria eletromagnética para determinar a razão entre a carga elétrica e a massa de um elétron.
( ) O modelo atômico de Dalton propôs que a matéria é constituída de minúsculas partículas, como uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga.
( ) Thomson propôs que um átomo podia ser imaginado como uma esfera com carga positiva uniforme de matéria, na qual os elétrons estão embutidos como passas em um bolo. Esse modelo chamado de “pudim de passas” foi a teoria aceita durante muitos anos.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é: