Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
Com base nesses conceitos, assinale a alternativa certa.
DADOS QUE PODEM SER USADOS NESTA PROVA
Assinale a opção que corresponde à reação química em que Kc = Kp.
Considere que, em solução aquosa, o H3AsO4 sofra três reações de dissociação ácida, cujas equações químicas estão expressas a seguir.
H3AsO4 (aq) ⇌ H+ (aq) + H2AsO4 − (aq)
H2AsO4 − (aq) ⇌ H+ (aq) + HAsO4 2− (aq)
HAsO4 2− (aq) ⇌ H+ (aq) + AsO4 3− (aq)
Nessa situação, a base conjugada da espécie H2AsO4 − é o íon HAsO4 2−.
Considerando-se que, no equilíbrio, [H3AsO3] = 7 × 10−3 mol/L, [Fe2+] = [H3AsO4] = 2,1 × 10−3 mol/L e que a constante de equilíbrio da reação em apreço seja igual a 3 × 107 , é correto inferir que, em pH 7, a concentração do íon Fe3+ é superior a 3 × 10−14 mol/L.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Conforme o princípio de Le Châtelier, caso a reação esteja em equilíbrio, um aumento na concentração de amônia deslocaria o equilíbrio no sentido da formação do complexo.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O valor da constante de equilíbrio da reação em apreço indica que a decomposição do complexo [Co(NH3)6] 2+ é favorecida.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Considere que, para a preparação do complexo, seja utilizada uma solução de cloreto de cobalto (II) anidro (CoCl2). Nesse caso, a relação entre o produto de solubilidade (Kps) do CoCl2 e sua solubilidade molar (cs) seriam corretamente representados por
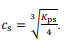
Se a concentração de uma solução de NaOH for de 0,10 mol/L, então o pH dessa solução será superior a 10.
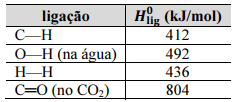
Assinale a opção em que são apresentadas duas ações que, do ponto de vista do equilíbrio químico, favorecem a conversão do metano no processo de sua reforma a vapor.
aumento da temperatura e redução da pressão do sistema
Considere-se que o SO2 atmosférico sofra hidrólise nas gotículas de água da atmosfera em uma série de reações reversíveis, conforme descrito a seguir.
SO2 (g) + H2O (l) ⇌ H2SO3 (aq)
H2SO3 (aq) ⇌ H+ (aq) + HSO3 − (aq)
HSO3 − (aq) ⇌ H+ (aq) + SO3 2− (aq)
Nessa situação, caso a concentração atmosférica de SO2 aumente, a concentração de íons SO3 2− dissolvidos na água da chuva aumentará.
No meio atmosférico, ocorrem numerosas reações que reduzem o enxofre do estado de oxidação +6 para o estado de oxidação +4, o que leva à formação de ácido sulfúrico (H2SO4), um dos ácidos mais fortes conhecidos.
1) Dissolveu-se uma pastilha de permanganato de potássio (KMnO4) em um becker contendo 40mL de água destilada, com formação da cor violeta. 2) A seguir, adicionou-se neste becker, 20mL de vinagre incolor, permanecendo a cor violeta. 3) Neste mesmo becker, adicionou-se 20mL de água oxigenada, H2O2 (10 vol.), e imediatamente a cor violeta desapareceu, ficando incolor. 4) Em outro becker, repetiu-se a etapa 1 desse procedimento, e logo a seguir adicionou-se 20mL de água oxigenada (10 vol.), ocorrendo a mudança da cor violeta para marrom.
Com relação a essa experiência, assinale a alternativa correta.
Em um experimento realizado por Thomas Graham, dois gases A e B foram liberados simultaneamente nas extremidades de um tubo de vidro; esses gases difundiram-se em direção ao centro do tubo e, no instante em que se encontraram, formaram um anel de um composto AB, como mostra a figura a seguir.
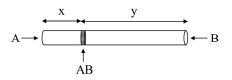
Para esses gases A e B, de massas molares MA e MB, respectivamente, verifica-se o seguinte postulado de Graham, em que vB representa a velocidade de difusão de B e vA, a velocidade de difusão de A.
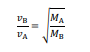
Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Considere que o gás cloreto de hidrogênio (HCl) possa
ser obtido a partir dos gases hidrogênio (H2) e cloro (Cl2)
por meio da reação reversível H2(g) + Cl2(g) ⇌ 2 HCl(g) e que
um frasco fechado, a uma dada temperatura, contenha
esses três gases em equilíbrio, com 20% de H2 e 60% de
Cl2 em volume, a uma pressão total de 10 atm. Nessas
condições, a constante de equilíbrio, no que se refere à
pressão, é superior a 0,25.
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O
Considerando as informações anteriores, julgue o item.
Caso a reação em apreço seja reversível e esteja sujeita às
leis do equilíbrio químico, um ambiente anaeróbico
favoreceria a produção de ácido cítrico.
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
Em solução aquosa, o ácido cítrico sofre três reações de dissociação ácida, cujas equações químicas estão corretamente expressas a seguir.
C6H8O7(aq) + H2O(l) ⇌ C6H7O7 − (aq) + H3O+ (aq)
C6H7O7 − (aq) + H2O(l) ⇌ C6H6O7 2−(aq) + H3O+ (aq)
C6H6O7
2−(aq) + H2O(l) ⇌ C6H5O7
3−(aq) + H3O+
(aq)
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
A primeira constante de dissociação ácida do ácido cítrico
(Ka1) é superior a 10−3.
N2 O4 (g) ⇌ 2 NO2 (g)
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
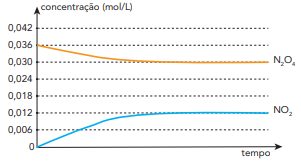
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a: