Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 633 questões
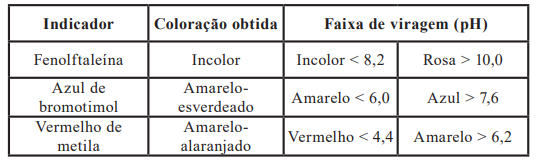
De acordo com o resultado obtido experimentalmente, pode-se seguramente afirmar que a faixa de pOH da amostra desconhecida, de acordo com a coloração obtida, encontra-se entre
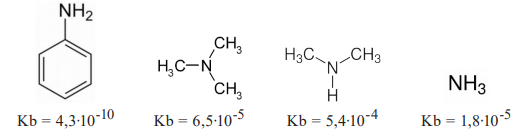

A ordem crescente de basicidade, das substâncias químicas acima citadas, é
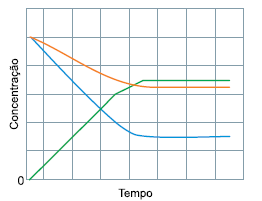
Esse gráfico está associado à seguinte reação química:
Considera-se que quando uma pessoa ingere dois copos de água, seu suco gástrico (solução de ácido clorídrico, pH igual a 1) dilui de 50 para 500 mL. Nessa condição o pH da solução restante logo após a ingestão da água será de:
I. Ocorrerá aumento do pH dessa solução. II. Ocorrerá diminuição do pH dessa solução. III. Não ocorrerá alteração do pH. IV. Ocorrerá precipitação de Ca(OH)2.
Marque a alternativa que indica a(s) afirmação(ões) correta(s):
I - É uma solução de pH menor que 7. II - É mais alcalina do que uma solução aquosa de NaCI. III- É mais ácida do que uma solução aquosa de NaOH de mesma concentração.
Quais estão corretas?
2 CO (g) + O2 (g) ⇋ 2 C02 (g)
Em um determinado recipiente, contendo inicialmente monóxido de carbono e oxigênio, estabeleceuse um equilíbrio em que se pode determinar a pressão total da mistura, 6,1 atm, e as pressões parciais de monóxido de carbono e de dióxido de carbono, as quais foram, respectivamente, 0,5 atm e 4,0 atm.
O valor da constante de equilíbrio será igual a
H2(g) ⇋ 2 H (g)
Sobre essa reação, são feitas as seguintes afirmações.
I - A quantidade de hidrogênio atômico aumenta com o aumento da temperatura, porque a reação é endotérmica. II - Em condições de baixa temperatura, não há energia suficiente para romper a ligação. III- A variação de entalpia envolvida na reação é o dobro da entalpia de formação do hidrogênio atômico nas condições da reação.
Quais estão corretas?
Em relação a uma solução aquosa saturada desse sal, contendo uma certa quantidade de sal sólido, não dissolvido, são feitas as seguintes afirmações.
I - A adição de nitrato de bário diminui a quantidade de sólido não dissolvido. II - A adição de sulfato de sódio aumenta a quantidade de sólido não dissolvido. III - Uma reação reversível, na qual a dissolução do sal é exatamente contrabalançada pela sua precipitação, é estabelecida nessa situação.
Quais estão corretas?
Dado: MM (KOH) = 56 g.mol-1
De acordo com as informações apresentadas, verifica-se que essa solução apresenta
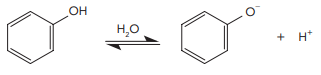
Considere um processamento no qual houve a dissolução completa de 0,01 mol de fenol em água para formar 1 L de solução a 20 °C. Nessa temperatura, a constante de acidez do fenol é igual a 10−10. Atingido o equilíbrio químico da ionização, a concentração de ânion fenolato, em mol/L, na solução, é aproximadamente igual a:
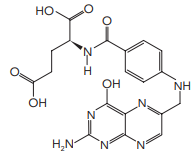
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
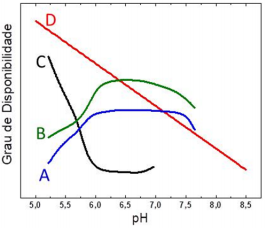
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos
Considere que uma colher de sopa de vinagre com um teor de ácido acético de 3,0 % (m/v) foi misturada com 4 colheres de sopa de água para ser usada em limpeza. O valor de pH do vinagre após a diluição é de:
Considere um frasco de contraste contendo 100 mL de suspensão de sulfato de bário na presença de sulfato de potássio 0,01 mol.L-1. A massa de bário presente na forma de íons Ba2+ na suspensão está na ordem de:
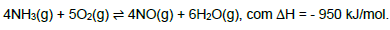
Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o):
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
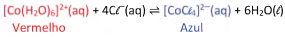
Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
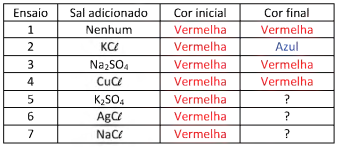
A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
