Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 633 questões
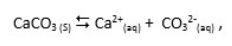
onde Kps é a constante do produto de solubilidade
A afirmação incorreta encontra-se na afirmativa
O equilíbrio químico:
X2(g) + Y2(g) ⇌ 2XY(g) ΔH < 0
Para aumentar a produção de XY(g), pode-se:
Conforme o equilíbrio químico abaixo, considere a solução saturada de dissolução do calcário na água, a afirmação incorreta é
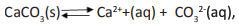
sendo que Kps é a constante do produto de
solubilidade,a afirmação incorreta é:
Fonte:<http://mundoeducacao.bol.uol.com.br/quimica/o-ph-solo-coloracao-das-plantas.htm>.
Considerando as informações acima, em um solo com concentração de íons OH- de 10-12 mols x L-1 , o pH desse solo e a cor das hortênsias nele plantadas serão
O incêndio na boate Kiss, em Santa Maria (RS), ocorrido no início deste ano [2013], trouxe à tona uma série de questões sobre a segurança dos estabelecimentos e também sobre o atendimento a vítimas de grandes incêndios. Uma delas é por que foi preciso trazer dos Estados Unidos uma substância tão simples – uma vitamina B injetável – para atender os pacientes que, segundo exames, foram intoxicados com cianeto?

O gás cianídrico liberado na queima da espuma, utilizada para melhorar a acústica da casa noturna, intoxicou a maior parte das vítimas, segundo perícia.
“É descaso e ignorância”, resume o toxicologista Anthony Wong, diretor do Ceatox (Centro de Assistência Toxicológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo). Segundo ele, é inadmissível que o país não tenha a substância e que seu uso não seja difundido entre médicos e socorristas, como acontece em outras partes do mundo.
A hidroxocobalamina, que faz parte do complexo B, é usada em altas concentrações como antídoto para o cianeto. O gás, o mesmo que já foi usado no extermínio de judeus nos campos de concentração nazistas, é subproduto da queima de diversos componentes usados na indústria, como o plástico, o acrílico e a espuma de poliuretano. Segundo os peritos que investigam o incêndio em Santa Maria, essa última foi usada no isolamento acústico da boate.
Capaz de matar em poucos minutos, o cianeto bloqueia a cadeia respiratória das células, impedindo que o oxigênio chegue aos órgãos e tecidos. Quando usada logo após a exposição, a hidroxocobalamina salva vidas. “O efeito é tão rápido que parece até milagroso”, conta Wong. Mas isso não é algo que os médicos aprendem na escola: “São poucas as faculdades que oferecem curso de toxicologia e, nas que tem, a matéria é opcional”.
(noticias.uol.com.br. Adaptado.)
Informações adicionais:
• O gás cianídrico é o cianeto de hidrogênio (HCN) no estado gasoso.
• A fórmula estrutural da hidroxocobalamina é:

• A massa molar da hidroxocobalamina é aproximadamente igual
a 1,3 × 10³g/mol.
Queixas chegaram à Vigilância Sanitária Estadual e foram relatadas por moradores de Canoas, São Leopoldo e Porto Alegre
Na zona sul da Capital, uma menina de 10 anos foi levada ao Hospital de Pronto Socorro (HPS) depois que sentiu uma forte ardência na boca e na garganta ao beber o produto, comprado pela avó dela, que é dona de um minimercado no bairro Guarujá. A garota foi medicada e retornou para casa nesta tarde. Segundo a responsável pelo setor de alimentos da Divisão de Vigilância Sanitária do Estado, Susete Lobo Saar de Almeida, uma análise laboratorial prévia do produto constatou alterações no pH da bebida. Esse índice, que aponta o quanto uma substância é ácida ou alcalina, estaria em torno de 13 — em uma escala que vai de zero a 14 — indicando grande alcalinidade no produto.
Fonte: http://zerohora.clicrbs.com.br
Qual das substâncias abaixo poderia ter causado o problema citado na reportagem?
Concentração de ácido acético: 6,0% m/V
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?” As seguintes informações foram fornecidas pelo professor:
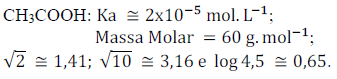
Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:
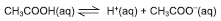
Dos sistemas em equilíbrio químico iônico em solução aquosa, um dos mais importantes é o que ocorre na ionização de ácidos e de bases, como o representado pela equação química, em que o ácido acético, em solução aquosa 0,1 mol.L–1, está 1,0% ionizado, à determinada temperatura.
Considerando-se essas informações, é correto afirmar:
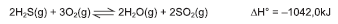
O deslocamento do equilíbrio químico de um sistema é toda e qualquer alteração de velocidade de reação direta ou inversa, que provoca modificações nas concentrações de substâncias químicas e, consequentemente, leva a um novo estado de equilíbrio.
A aplicação desse conceito de deslocamento de equilíbrio químico ao sistema representado pela equação química permite corretamente afirmar:
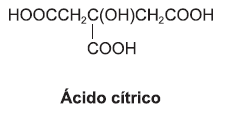
O ácido cítrico, responsável pela acidez das frutas cítricas, é utilizado como acidificante e flavorizante no processamento de alguns alimentos.
A partir dessas informações, é correto afirmar:
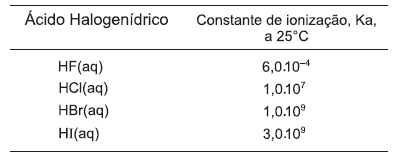
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
Em um recipiente de 2,0L, foram misturados 12,0mol de dióxido de enxofre, SO2(g), com 10,0mol de oxigênio, O2(g), à determinada temperatura. Após ter sido fechado o recipiente, e depois de estabelecido o equilíbrio químico, o sistema, representado pela equação química, apresentou 8,0mol de trióxido de enxofre, SO3.
A partir dessas informações e da análise do equilíbrio químico do sistema considerado, é correto afirmar:
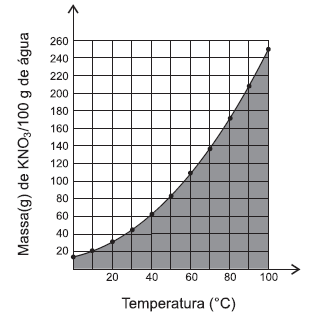
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
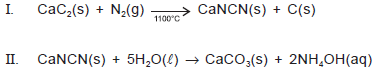
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100°C, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
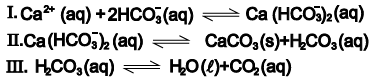
As algas zooxanthellae são também responsáveis pela intensa precipitação de carbonatos no esqueleto dos corais escleractíneos principais formadores dos recifes. Em pH próximo a 8,5, a maior parte do CO2 (aq) disponível na água do mar se encontra na forma de íons bicarbonato, HCO3- (aq). Devido à intensa radiação solar, os corais e os invertebrados que possuem algas simbiontes — sensíveis a pequenas alterações de temperatura — capturam ativamente íons de cálcio, Ca2+(aq), que reagem com íons bicarbonato.O bicarbonato de cálcio se decompõe em carbonato de cálcio, que se precipita sob forma de esqueleto, e ácido carbônico, H2CO3 (aq), usado na fotossíntese. Trata-se de um processo bioquímico muito eficiente, porém sujeito às alterações das concentrações de CO2 (g), na atmosfera.
Uma análise do processo bioquímico de formação de esqueleto de carbonato de cálcio dos corais escleractíneos referidos no texto e de acordo com as equações químicas I, II e III, permite afirmar:
Considere o sistema em equilíbrio a 25°C e 1 atm que representa a queima ou combustão do metanol líquido:
2CH3OH (l) + 3 O2 (g) ⇄ 2CO2(g) + 4H2O(l) H = -1452 kJ
Assinale a alternativa VERDADEIRA:
No equilíbrio, a produção de SO3 pode variar em função das condições operacionais. Duas destas condições estão representadas nas figuras 2 e 3.
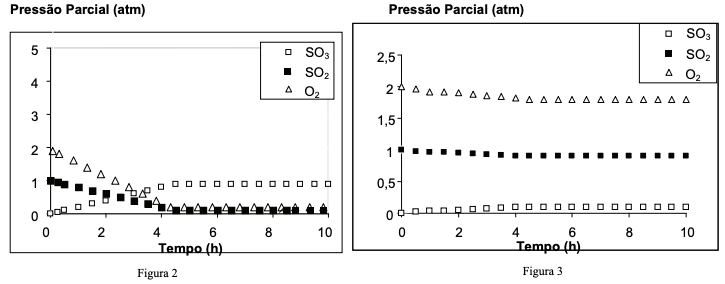
A partir destas informações, indique com V as alternativas verdadeiras e com F as alternativas falsas.
( ) A figura 2 corresponde a um processo ocorrido a temperatura de 400oC, com um valor da constante de equilíbrio, Kp, elevado. ( ) A figura 3 corresponde a um processo ocorrido a temperatura de 700oC com um valor da constante de equilíbrio, Kp, elevado. ( ) A figura 2 corresponde a um processo ocorrido a temperatura de 400oC com um valor da constante de equilíbrio, Kp, baixo. ( ) A figura 3 corresponde a um processo ocorrido a temperatura de 700oC com um valor da constante de equilíbrio, Kp, baixo.
Assinale a alternativa que indique a seqüência exata:
SO2(g) + ½ O2(g)
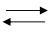 SO3(g) + calor
SO3(g) + calor
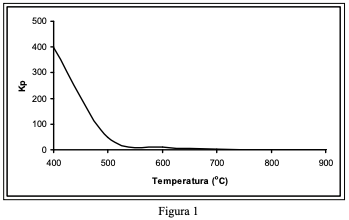
Nas Figuras a seguir são apresentadas a influência da temperatura em função do tempo de conversão para atingir o equilíbrio (Figura 1) e a influência da temperatura sobre a percentagem de conversão de SO2 em SO3 no equilíbrio (Figura 2).
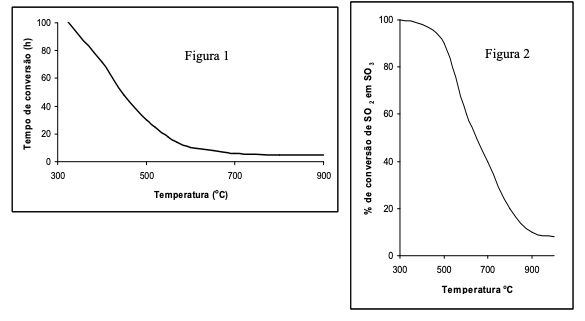
Analisando os gráficos, assinale a alternativa que representa a melhor condição de processo para aumentar a velocidade e o rendimento de SO3 .
CO2(g) ↔ CO2(aq) ΔH = –14,8 kJ/mol
Suponha que a geração de espuma esteja relacionada à quantidade de gás liberado durante a abertura da garrafa e que duas garrafas sejam abertas no mesmo bar, uma a 6 oC e outra a 25 oC.
Em relação à acidez da cerveja, pode-se concluir que:
