Questões de Vestibular de Química - Equilíbrio Químico
Foram encontradas 630 questões
I – pH = 5,4 II – pOH = 10 III – pOH = 8,5
Considerando a faixa de pH permitida, qual(is) a(s) indústria(s) que pode(m) lançar seu efluente nos corpos de água sem tratamento preliminar?
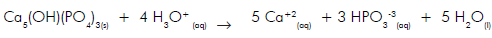
Ao adicionarmos esse fosfato natural em solos ácidos ocorrerá
Dentre os equilíbrios químicos,
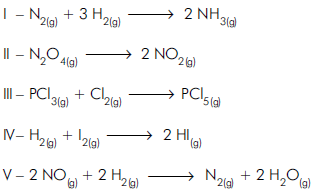
aquele com Kp = Kc é o
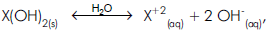
tem um pH = 10, a 25°C. O produto de solubilidade do X(OH)2 é
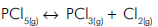
[X2] = 0,20, [Y2] = 0,20, [XY3] = 0,60
O valor da constante de equilíbrio da reação química é de:
A altas temperaturas, N2 reage com O2 produzindo NO, um poluente atmosférico:
N2(g) + O2(g) ⇌ 2NO(g)
À temperatura de 2000 kelvins, a constante do equilíbrio acima é igual a 4,0 x 10-4. Nesta temperatura, se as concentrações de equilíbrio de N2 e O2 forem, respectivamente, 4,0 x 10-3 e 1,0x10-3 mol/L, qual será a de NO?
[PCl5] = 1,5 mol/L, [Cl2] = 0,3 mol/L
A concentração molar de PCl3 no equilíbrio é :
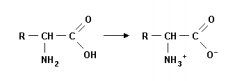
I. Soluções ácidas são aquelas que têm pH < 6,5. II. Soluções neutras têm pH = 6,5 III. Soluções básicas têm pH > 6,5. IV. pH+pOH tem que ser igual a 13,0. V. Solução com pH = 14 é impossível de ser obtida.
Das afirmações anteriores estão CORRETAS:
I. Soluções ácidas são aquelas que têm pH < 6,5. II. Soluções neutras têm pH = 6,5 III. Soluções básicas têm pH > 6,5. IV. pH+pOH tem que ser igual a 13,0. V. Solução com pH = 14 é impossível de ser obtida.
Das afirmações anteriores estão CORRETAS:
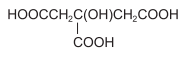
Ácido cítrico
A partir dessas informações, é correto afirmar: