Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
Tendo por base esta informação, assinale a afirmação verdadeira.
A remoção de metais pesados de um efluente, muitas vezes, pode ser feita pela precipitação do elemento na forma de um composto pouco solúvel. Considere o exemplo do chumbo, na forma de íon bivalente positivo, que possui vários compostos insolúveis:
Composto Produto de Solubilidade (Kps)
PbCl2 1,6x10–5
PbSO4 1,6x10–8
PbS 8,8x10–29
HCO3 – (aq) + H2O(l)
 CO3
2–(aq) + H3O
+
(aq)
CO3
2–(aq) + H3O
+
(aq) A respeito de uma solução em que as concentrações de carbonato (CO3 2–) e bicarbonato (HCO3 – ) são iguais, podemos dizer que:
CO(g) + 2 H2(g)
 CH3OH(g)
CH3OH(g)
Com relação a esse equilíbrio, três afirmações foram feitas:
1) A formação de metanol é favorecida pela remoção de CO.
2) O aumento da pressão não influencia o equilíbrio.
3) A adição de gás hidrogênio favorece a formação de metanol.
Está(ão) correta(s) a(s) afirmativa(s):
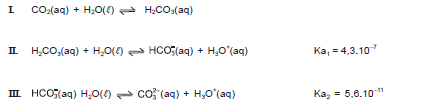
Considerando-se as informações do texto, o sistema em equilibrio, a acidificação dos oceanos e alguns impactos causados às baleias e aos ecossistemas marinhos, associados aos conhecimentos das Ciências da Natureza, é correto afirmar:
DADOS QUE PODEM SER USADOS NESTA PROVA:

A quimioesfoliação (peeling químico) consiste na aplicação de substâncias químicas na pele, visando à renovação celular e eliminação de rugas. Apesar de envolver algum risco à saúde, algumas pessoas utilizam esse processo para manter uma imagem jovem. Para um peeling superficial ou médio, costuma-se usar uma solução da seguinte substância:
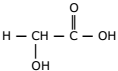
Atente ao que se diz a respeito dessa substância:
I. Essa substância é um éster.
II. Libera H+ quando se encontra em solução aquosa.
III. Uma diminuição da concentração de H+ leva também a uma diminuição do pH.
IV. Na reação de ionização, essa substância se transforma na seguinte espécie:
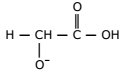
É correto o que se afirma somente em

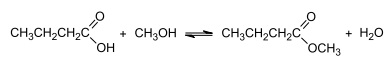 Aroma de maçã
Aroma de maçã Em um teste de laboratório, foram adicionados 10 mol de

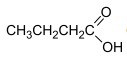 e n mol de CH3OH a um reator de 1 L. O
reator foi fechado e, ao se atingir o equilíbrio reacional, verificou-se a formação de 9 mol, da substância com aroma de
maçã e 9 mol de H2O.
e n mol de CH3OH a um reator de 1 L. O
reator foi fechado e, ao se atingir o equilíbrio reacional, verificou-se a formação de 9 mol, da substância com aroma de
maçã e 9 mol de H2O. Considerando que a constante de equilíbrio referente às condições de temperatura e pressão do processo é K eq = 9, o valor correto da quantidade, em mol, de CH3OH adicionado ao reator é
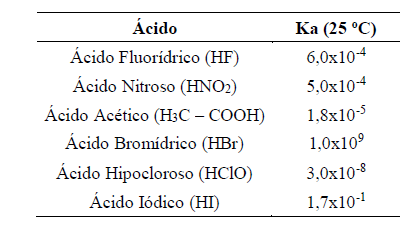 Com base na análise da Tabela 2, é CORRETO concluir que:
Com base na análise da Tabela 2, é CORRETO concluir que:Foram preparadas misturas de acordo com a descrição a seguir:
I: 100 mL de H2O e 4,9 g de H2SO4
II: 100 mL de H2O e 4,48 g de KOH
III: 100 mL de H2O e 0,5 g de AgOH
Dado: KpS AgOH = 10-8
Todas as afirmativas são verdadeiras, EXCETO:
A amônia é um composto importante na indústria de produção de fertilizantes e ácido nítrico. Na indústria americana ela figura entre as cinco substâncias mais produzidas. O processo utilizado para produção de amônia é conhecido como processo Haber. Fritz Haber descobriu o método de sintetizar a amônia diretamente de seus elementos. Observe abaixo algumas considerações de Haber em seu estudo.

Para aumentar a velocidade da reação usa-se um catalisador misturando Fe3 O4 com KOH, SiO2 e Al2O3 , mas que só é eficiente acima de 400 oC.
A respeito deste processo assinale a alternativa correta.
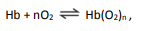
em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal.
A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
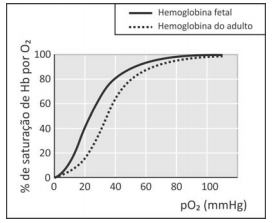
A porcentagem de saturação pode ser entendida como :
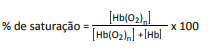
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
É correto apenas o que o estudante afirmou em
A força dos ácidos pode ser considerada como um parâmetro que mede a quantidade de íons H+ liberados para solução quando diluídos em água.
Sobre a força dos ácidos, o grau de ionização e o cálculo do pH, relacione a coluna da esquerda com a da direita.
(I) CH3COOH (Ka = 1,80×10−5 ) (II) HCℓ (Ka = 1,00×107) (III) HF (Ka = 6,70×10−4) (IV) HCN (Ka = 4,90×10−10) (V) HNO2 (Ka = 6,09×10−6)Assinale a alternativa que contém a associação correta.

A produção da essência de maçã-verde pode ser favorecida pelo deslocamento desse equilíbrio por meio
Com relação às informações, analise as proposições.
I. A solução A contém um ácido forte, com concentração de 0,01000 mol L-1 e a solução B contém um ácido fraco com concentração 1,000x10-4 M. II. As duas soluções contêm a mesma concentração de ácido igual a 0,01000 M, mas os ácidos têm diferentes graus de dissociação. III. Uma vez que o pH das amostras é diferente, a concentração dos ácidos em cada uma é necessariamente diferente. IV. As duas soluções contêm a mesma concentração de ácido, mas o ácido presente na solução A está completamente dissociado, e o ácido na solução B está apenas 1% dissociado. V. A medição apenas do pH não informa sobre a concentração total de ácido, mas apenas sobre a fração de ácido que está dissociada.
Assinale a alternativa correta.
Considere o equilíbrio químico a seguir:
X + Y ⇌ 2 Z
Sabendo que todas as substâncias acima estão no estado gasoso, assinale a alternativa correta:
Deixou-se o NO(g) borbulhar até que fossem acrescidos ao tubo 4 mL desse gás. Após cessar o fluxo de NO(g), o tubo foi mantido imerso na posição vertical, de modo que seu volume pudesse variar, mantendo a pressão em seu interior igual à pressão exterior, mas sem escape de gás. Após certo tempo, o gás dentro do tubo adquire cor castanha, em função da seguinte reação: 2NO(g) + O2(g)
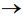 2NO2 (g)
2NO2 (g)
A respeito desse experimento, identifique as afirmativas abaixo como verdadeiras (V) ou falsas (F):
( ) O NO(g) é reagente limitante da reação. ( ) Em relação à condição imediata depois de cessado o fluxo, o volume de gás dentro do tubo irá diminuir após o gás ficar castanho. ( ) Em relação à condição imediata depois de cessado o fluxo, a pressão parcial de N2(g) dentro do tubo irá aumentar após o gás ficar castanho. ( ) O valor de pH da água na região A (dentro do tubo) irá diminuir após o gás se tornar castanho.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.

