Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 630 questões
HCN (aq)⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo grau de ionização α constante de equilíbrio Ka potencial hidrogeniônico pH concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização. O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3 .
Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq) ⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
As antocianinas existem em plantas superiores e são responsáveis pelas tonalidades vermelhas e azuis das flores e frutos. Esses corantes naturais apresentam estruturas diferentes conforme o pH do meio, o que resulta em cores diferentes.
O cátion flavílio, por exemplo, é uma antocianina que apresenta cor vermelha e é estável em pH ≈ 1. Se juntarmos uma solução dessa antocianina a uma base, de modo a ter pH por volta de 5, veremos, durante a mistura, uma bonita cor azul, que não é estável e logo desaparece.
Verificou-se que a adição de base a uma solução do cátion flavílio com pH ≈ 1 dá origem a uma cinética com 3 etapas de tempos muito diferentes. A primeira etapa consiste na observação da cor azul, que ocorre durante o tempo de mistura da base. A seguir, na escala de minutos, ocorre outra reação, correspondendo ao desaparecimento da cor azul e, finalmente, uma terceira que, em horas, dá origem a pequenas variações no espectro de absorção, principalmente na zona do ultravioleta.
(Paulo J. F. Cameira dos Santos et al. “Sobre a cor dos vinhos:
o estudo das antocianinas e compostos análogos não parou
nos anos 80 do século passado”. www.iniav.pt, 2018. Adaptado.)
A variação de pH de ≈1 para ≈5 significa que a concentração de íons H+ (aq) na solução ________ , aproximadamente, _______vezes. Entre as etapas cinéticas citadas no texto, a que deve ter maior energia de ativação e,
portanto, ser a etapa determinante da rapidez do processo
como um todo é a _________.
As lacunas do texto são preenchidas, respectivamente, por:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Considerando que no equilíbrio a 60 °C, a pressão parcial do tetróxido de dinitrogênio é 1,4 atm e a pressão parcial do dióxido de nitrogênio é 1,8 atm, a constante de equilíbrio Kp será, em termos aproximados,
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
DADOS QUE PODEM SER USADOS NESTA PROVA:

A quimioesfoliação (peeling químico) consiste na aplicação de substâncias químicas na pele, visando à renovação celular e eliminação de rugas. Apesar de envolver algum risco à saúde, algumas pessoas utilizam esse processo para manter uma imagem jovem. Para um peeling superficial ou médio, costuma-se usar uma solução da seguinte substância:
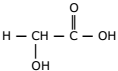
Atente ao que se diz a respeito dessa substância:
I. Essa substância é um éster.
II. Libera H+ quando se encontra em solução aquosa.
III. Uma diminuição da concentração de H+ leva também a uma diminuição do pH.
IV. Na reação de ionização, essa substância se transforma na seguinte espécie:
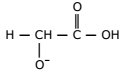
É correto o que se afirma somente em
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
2 NO(g) + O2(g)⇽⇾ 2 NO2(g) ΔH <0
Considerando o sistema acima em equilíbrio, é correto afirmar-se que a produção de dióxido de nitrogênio será favorecida quando se
Analise as afirmativas.
I - A elevação do pH de uma piscina favorece a dissolução dos floculantes presentes na água.
II - O pH de um suco de tomate, em média, deverá ser igual a 4,2 – aproximadamente 1000 vezes mais ácido que a água de uma piscina em boas condições.
III - No tratamento de uma piscina é comum a utilização de barrilha (Na2CO3 – carbonato de sódio) para a elevação do pH, pois produz uma solução de caráter alcalino.
IV - No tratamento de microrganismos em piscinas, é comum a utilização de sais de hipoclorito, que fornecem à água o íon Cl-1(aq).
São verdadeiras, apenas

 Aroma de maçã
Aroma de maçã Em um teste de laboratório, foram adicionados 10 mol de

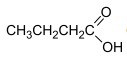 e n mol de CH3OH a um reator de 1 L. O
reator foi fechado e, ao se atingir o equilíbrio reacional, verificou-se a formação de 9 mol, da substância com aroma de
maçã e 9 mol de H2O.
e n mol de CH3OH a um reator de 1 L. O
reator foi fechado e, ao se atingir o equilíbrio reacional, verificou-se a formação de 9 mol, da substância com aroma de
maçã e 9 mol de H2O. Considerando que a constante de equilíbrio referente às condições de temperatura e pressão do processo é K eq = 9, o valor correto da quantidade, em mol, de CH3OH adicionado ao reator é
1 N2(g) + 3 H2(g) ⇌ 2 NH3(g) ∆H = –17 kcal/mol
A respeito desse equilíbrio, assinale a afirmativa incorreta.
Sobre equilíbrio químico, são dadas as seguintes informações:
I. O grau de equilíbrio consiste na razão entre o número de mols consumidos de um certo reagente e seu número de mols inicial.
II. Na constante de equilíbrio da concentração molar (Kc) devem ser representados os componentes sólidos.
III. Na constante de equilíbrio em termos das pressões parciais dos gases(Kp), só devem ser representados os componentes gasosos
IV. De acordo com o Princípio de Le Chatelier, o aumento de pressão, o equilíbrio se desloca para o lado de menor volume (menor número de mols), a diminuição da temperatura, desloca o equilíbrio no sentido da reação exotérmica e catalisadores deslocam o equilíbrio.
Indique a opção correta:
X(g) + Y(g) ⇌ XY(g)
Considerando que as pressões iniciais de X e Y sejam respectivamente iguais a 3 atm e 2 atm e que a pressão total no equilíbrio seja igual a 4,2 atm, assinale a alternativa correta a respeito desta reação, nas condições indicadas:
Um sistema químico em equilíbrio, a uma dada temperatura, contém os gases N2, H2 e NH3, como mostra a equação a seguir.
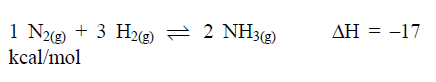
A respeito desse equilíbrio, assinale a afirmativa
incorreta.
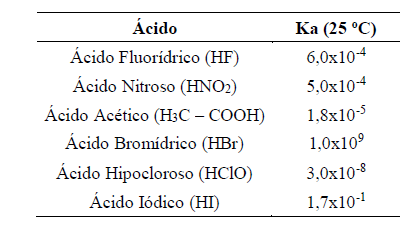 Com base na análise da Tabela 2, é CORRETO concluir que:
Com base na análise da Tabela 2, é CORRETO concluir que:FIGURA 03
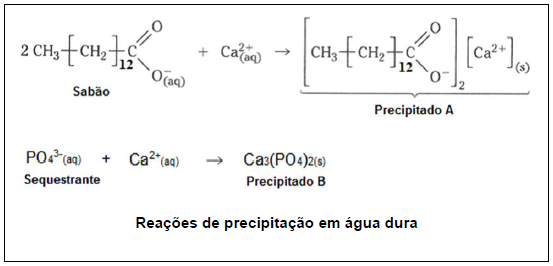
De acordo com as informações anteriores, pode-se inferir que o sequestrante contribui para diminuir o problema dos sabões em água dura, porque:
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K

