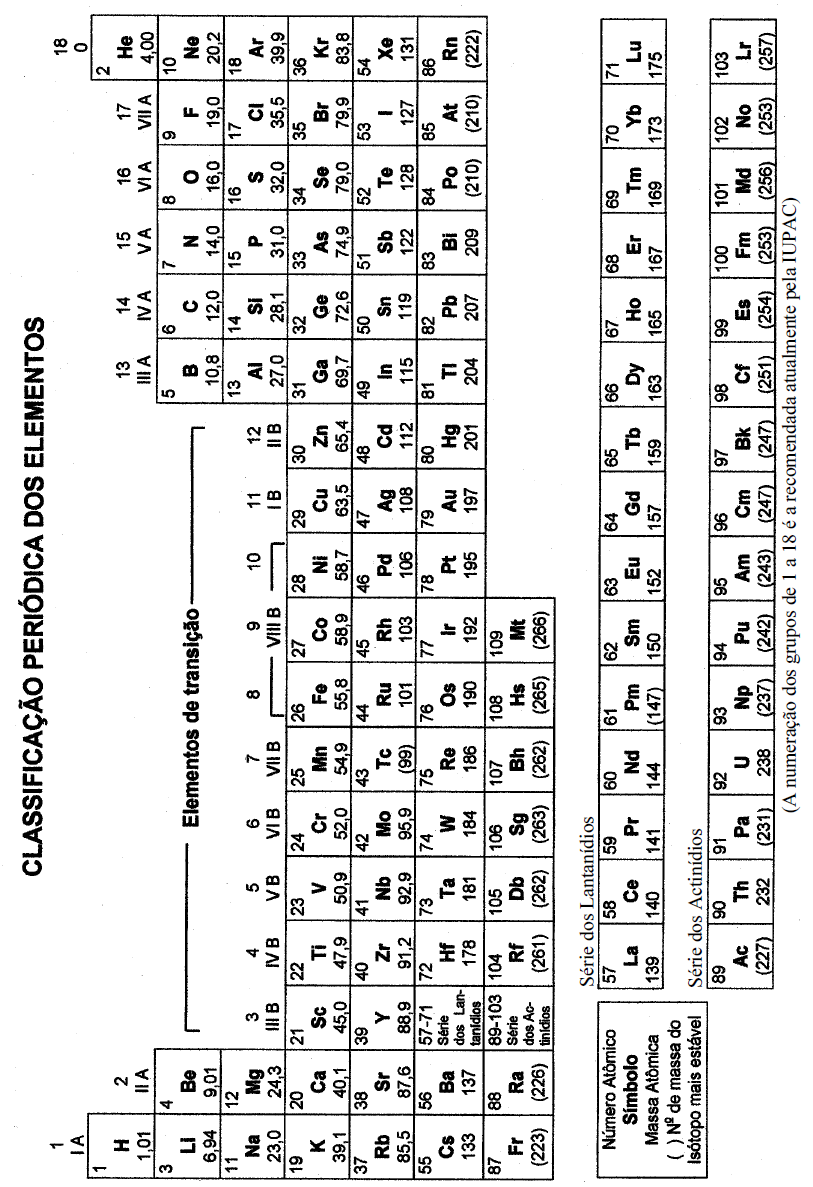
Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 630 questões
O medicamento utilizado para destacar órgãos em exames radiológicos pode ter causado a morte de pelo menos 21 pessoas no país. Sua matéria-prima é o sulfato de bário. Análise preliminar da Fiocruz (Fundação Oswaldo Cruz) apontou a presença de carbonato de bário em um lote do produto distribuído por determinado laboratório. O carbonato de bário é utilizado em venenos para rato. Pacientes tomam sulfato de bário para que os órgãos de seu sistema digestório fiquem visíveis nas radiografias. É o chamado contraste.
Considere que o Ks do sulfato de bário é 1 x 10-10 .
O sulfato de bário é administrado na forma de uma suspensão.
Disponível em: <http://www1.folha.uol.com.br/folha/cotidiano/ult95u76538.shtml> Acesso em: 10 ago. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma suspensão de sulfato de bário deve conter cerca de 0,00137 g de bário dissolvido.
O dióxido de carbono pode ser formado a partir da reação do monóxido de enxofre com o oxigênio expressa pela equação não balanceada: CO(g) + O2(g)  CO2(g) .Assinale a opção que representa corretamente o efeito provocado pela retirada de dióxido de carbono.
CO2(g) .Assinale a opção que representa corretamente o efeito provocado pela retirada de dióxido de carbono.
A + B ⇌ C + D
O valor numérico da constante de equilíbrio, Kc, será igual a:
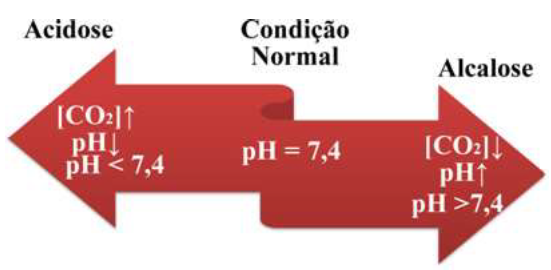
O gás carbônico, dissolvido no sangue, estabelece o seguinte equilíbrio químico:
CO2 + H2O ⇄ H2CO3 ⇄ H+ + HCO3 -
Uma pessoa fumante, com respiração deficiente em função de enfisema pulmonar, possui a transferência de gás carbônico reduzida para o exterior. Nessa situação, pode ocorrer

Uma
pessoa ao temperar sua salada utilizou apenas uma pitada de sal (cloreto de
sódio) e aproximadamente 3 mL de vinagre (solução aquosa contendo ácido
acético) e 9 mL de água. Considere que o sal não influenciará o pH, que o
vinagre é uma solução 4% (m/v) de ácido acético (CH3COOH), sendo esta a
substância responsável pelo caráter ácido desta solução.
(Dados:
densidade do vinagre = 1 ,05 g/mL; Ka=1,75x10-5)
A expressão de equilíbrio do ácido acético é:

Uma
das consequências do aumento do dióxido de carbono na atmosfera é a
acidificação dos oceanos. Naturalmente, tem-se o equilíbrio químico entre o
dióxido de carbono da atmosfera e o dissolvido nos oceanos. Com o aumento de
dióxido de carbono nas águas oceânicas esse equilíbrio é perturbado, e, logo,
organismos vivos constituídos, principalmente, de carbonato de cálcio, são
prejudicados.
Sobre o aumento da acidez nos oceanos e as suas
consequências, analise as proposições.
I. A
acidificação dos oceanos ocorre devido à reação química entre o gás carbônico
dissolvido e a água, resultando na formação do ácido carbônico cuja fórmula
química é HCO3.
II. Os
íons carbonatos provenientes do equilíbrio do carbonato de cálcio reagem com os
íons H+ gerados pelo ácido carbônico,
a fim de compensar o excesso de acidez gerado no oceano.
III. O
caráter mais ácido dos oceanos favorece a descalcificação dos exoesqueletos dos
corais, assim como dificulta a formação de novas estruturas de carbonato de
cálcio.
Assinale
a alternativa correta.
Em uma aula de laboratório de química, foi realizado um experimento que consistiu em adicionar em um béquer 300 g de água, em temperatura ambiente, e certa quantidade do sal sulfato de magnésio hexaidratado (MgSO4 . 6H2O) até formar uma solução saturada com corpo de fundo. Essa mistura foi aquecida até completa solubilização do sal, que ocorreu quando a temperatura atingiu 50 ºC. Na sequência, deixou-se a solução resfriar até 20 ºC e verificou-se novamente a presença do sal cristalizado no fundo do béquer.
Foram fornecidos aos alunos os dados de solubilidade desse sal nas duas temperaturas medidas.
Com as informações fornecidas, foram calculadas as massas do sal presente na solução a 50 ºC e do sal cristalizado
a 20 ºC. Esses resultados são corretamente apresentados,
nessa ordem, em:
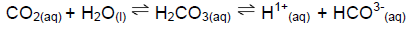 Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o
Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o 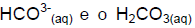 é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao
organismo, devido às alterações metabólicas, podendo causar a morte.
é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao
organismo, devido às alterações metabólicas, podendo causar a morte. Levando em conta as informações acima, é correto afirmar que
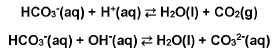
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
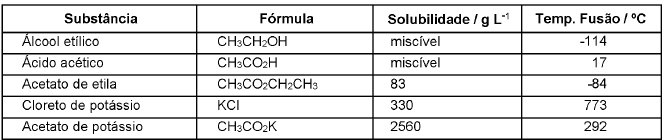
Qual das substâncias acima é a adequada para se preparar a solução de preenchimento desse tipo de extintor?
Os fertilizantes utilizados na reposição dos elementos químicos indispensáveis para o desenvolvimento dos vegetais são constituídos por sais inorgânicos, como o nitrato de potássio, KNO3(s), hidrogeno-fosfato de cálcio, CaHPO4(s), cloreto de amônio, NH4Cl(s), dentre outros. Os nutrientes são absorvidos pelas raízes das plantas sob a forma de íons, obtidos pela dissolução dos sais na água retida no solo, e dependem do pH do ambiente.
Com base nas informações associadas às estruturas e às propriedades dos sais inorgânicos, é correto afirmar
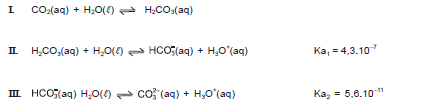
Considerando-se as informações do texto, o sistema em equilibrio, a acidificação dos oceanos e alguns impactos causados às baleias e aos ecossistemas marinhos, associados aos conhecimentos das Ciências da Natureza, é correto afirmar:
O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
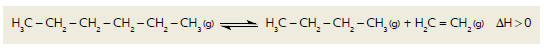
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob
temperatura T1
e pressão P1
. Após seis horas, a temperatura foi elevada para T2 , mantendo-se a
pressão em P1
. Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi
mantida em T2
.
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em:
O monóxido de carbono, formado na combustão incompleta em motores automotivos, é um gás extremamente tóxico. A fim de reduzir sua descarga na atmosfera, as fábricas de automóveis passaram a instalar catalisadores contendo metais de transição, como o níquel, na saída dos motores.
Observe a equação química que descreve o processo de degradação catalítica do monóxido de carbono:
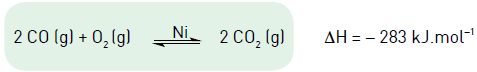
Com o objetivo de deslocar o equilíbrio dessa reação, visando a intensificar a degradação catalítica do monóxido de carbono, a alteração mais eficiente é:
HCN (aq) ⇔ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro: grau de ionização
Símbolo: α
Parâmetro: constante de equilíbrio
Símbolo: Ka
Parâmetro: potencial hidrogeniônico
Símbolo: pH
Parâmetro: concentração de HCN
Símbolo: [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
H3C − CH2 − CH2 − CH2 − CH2 − CH3 (g) ⇌ H3C − CH2 − CH2 − CH3(g) + H2C = CH2 (g) ∆H >0
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob temperatura T1 e pressão P1 . Após seis horas, a temperatura foi elevada para T2 , mantendo-se a pressão em P1 . Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi mantida em T2 .
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em: