Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 634 questões
C (s) + CO2 (g) ⇌ 2CO (g) ; ∆H = +88 kJ / mol de CO (g)
O rendimento em CO (g) desse equilíbrio aumenta com o aumento da , com a diminuição da e não se altera pela adição de .
As lacunas do texto são, correta e respectivamente, preenchidas por:
HCN (aq) ⇔ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro: grau de ionização
Símbolo: α
Parâmetro: constante de equilíbrio
Símbolo: Ka
Parâmetro: potencial hidrogeniônico
Símbolo: pH
Parâmetro: concentração de HCN
Símbolo: [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
HCN (aq)⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo grau de ionização α constante de equilíbrio Ka potencial hidrogeniônico pH concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização. O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq) ⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
A fenolftaleína atua como um indicador ácido-base por ser um ácido fraco, que em solução alcóolica, apresenta a cor das moléculas não-dissociadas, HInd, diferente da cor dos respectivos íons, Ind–.
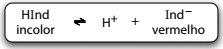
A leitura da mensagem no experimento descrito é possível
porque a presença de íons OH– na solução de fenolftaleína
promove deslocamento do equilíbrio para a
Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
Para obtermos 100 mL de uma solução aquosa saturada de hidróxido de cálcio, Ca(OH)2, para o experimento, devemos levar em consideração a solubilidade desse composto.
Sabendo que o produto de solubilidade do hidróxido de cálcio é 5,5 x 10-6, a 25 °C, a solubilidade dessa base em mol/L é, aproximadamente,
Dados:
Ca(OH)2(s) ⇌ Ca2+(aq) + 2OH–(aq)
Kps = [Ca2+] . [OH–]
2
Considerando essa situação e, ainda, que as soluções apresentem comportamento ideal, que a constante de autoionização da água seja igual a 1,0 × 10-14 e que log 5 = 0,70, julgue o item e faça o que se pede no item, que é do tipo B.
Calcule a concentração de H2SO4 na amostra de chuva ácida.
Multiplique o resultado obtido por 105
. Depois de efetuados
todos os cálculos solicitados, despreze, para a marcação no
Caderno de Respostas, a parte fracionária do resultado final
obtido, caso exista.
Considerando essa situação e, ainda, que as soluções apresentem comportamento ideal, que a constante de autoionização da água seja igual a 1,0 × 10-14 e que log 5 = 0,70, julgue o item.
O pH da solução padrão de NaOH é igual a 12,7.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
O consumo dos íons carbonato em meio ácido aumenta a
solubilidade do CaCO3 e do Na2CO3, o que acelera a
degradação de monumentos, conforme mencionado no texto.
A chuva ácida intensifica a degradação de monumentos históricos. A maioria desses monumentos é feita de mármore, que é o carbonato de cálcio na forma cristalina, CaCO3(s), e de pedra-sabão, que tem o carbonato de sódio, Na2CO3(s), como um de seus constituintes. Esses sais, CaCO3(s) e Na2CO3(s), são pouco solúveis em água, mas, em meio ácido, o íon carbonato é convertido em H2CO3, o qual, por sua vez, decompõe-se em água e CO2, conforme a equação de equilíbrio apresentada abaixo.

A partir dessas informações, e considerando que uma solução saturada de CaCO3 apresente comportamento ideal e que a constante de solubilidade do CaCO3 seja igual a 8,1 × 10-9 , julgue o item que se segue.
A solubilidade do CaCO3 em água pura, a 25 ºC, é igual a
9,0 mg/L.
A base de uma escultura é formada por uma placa de latão, uma liga metálica de zinco (Zn) e cobre (Cu). Para minimizar os problemas relacionados à corrosão provocada pela chuva ácida, a placa foi recoberta com uma fina camada de prata (Ag). O recobrimento foi realizado a partir da eletrólise de uma solução aquosa de AgCl, fixando-se a placa de latão no anodo da célula eletrolítica. A voltagem foi ajustada de forma a se obter corrente constante de 10,0 A.

Considerando as informações acima e assumindo que a constante de Faraday seja igual a 96.500 C/mol e que os únicos produtos formados nos eletrodos da célula eletrolítica sejam O2(g) e Ag(s), julgue o item seguinte.
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
O gráfico apresentado a seguir indica situações referentes à perturbação do equilíbrio químico indicado pela equação
H2(g) + I2(g) 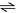 2 HI(g)
2 HI(g)
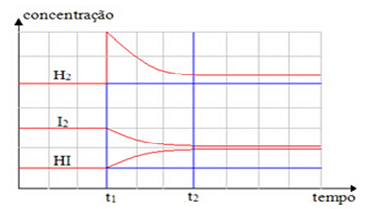
A partir da equação química apresentada e da observação do gráfico, considerando também que a reação é endotérmica
em favor da formação do ácido iodídrico, a dinâmica do equilíbrio favorecerá
Os efeitos tóxicos do dióxido de carbono exigem a sua remoção contínua de espaços fechados. A reação entre hidróxido de lítio e de dióxido de carbono é usada para remover o gás de naves espaciais e submarinos. O filtro utilizado nestes equipamentos é basicamente composto de hidróxido lítio. O ar seria direcionado para o filtro através de ventiladores, ao entrar em contato com o hidróxido de lítio presente nos filtros ocorre a reação com o dióxido de carbono existente no ar. A reação global é exotérmica, formando carbonato de lítio sólido e água no estado gasoso.
Disponível em: <http://www.abq.org.br/cbq/2014/trabalhos/14/4463-18723.html>.
Analisando o texto e a reação não balanceada, assinale a alternativa CORRETA.
CO2(g) + LiOH(s) → Li2CO3(s) + H2O(v)
TEXTO 8
Aos 60 anos, Rossmarc foi confinado na cadeia Raimundo Pessoa em Manaus, dividindo uma cela com 80 detentos. Dormia no chão junto de uma fossa sanitária. Para manter-se vivo usava toda a sua inteligência para fazer acordos com os detentos. Lá havia de tudo: drogados, jagunços, pseudomissionários, contrabandistas etc. Fora vítima do advogado. Com toda a lábia, nunca fora a Brasília defender Rossmarc. Por não ter apresentado a defesa, foi condenado a 13 anos de prisão. O advogado sumira, Rossmarc perdera o prazo para recorrer. Como era estrangeiro, os juízes temiam que fugisse do Brasil. O juiz ordenou sua prisão imediata. A cela, com oitenta detentos, fervilhava, era mais do que o inferno. Depressivo, mantinha-se tartamudo num canto, remoendo sua história, recordando-se dos bons tempos em que navegava pelos rios da Amazônia com seus amigos primatas.
Visitas? Só a de Pássaro Azul. Mudara-se também para Manaus e, sem nada dizer a Rossmarc, para obter dinheiro, prostituía-se num cabaré. Estava mais magra e algumas rugas se mostravam em seu rosto antes reluzente, agora de cor negra desgastada. Com o intuito de obter dinheiro, tanto para Rossmarc pagar as contas de dois viciados em crack no presídio, como para as custas de um advogado inexperiente, pouco se alimentava e ao redor dos olhos manchas entumecidas apareciam, deixando-a como alguém que consumia droga em exagero. As noitadas no cabaré enfumaçado e fedorento deixavam-na enfraquecida. Mas não deixara de amar o biólogo holandês. Quando fugira do quilombola, naquela noite, jurara amor eterno e não estava disposta a quebrar o juramento.
Enquanto Pássaro Azul se prostituía para obter os escassos recursos, Rossmarc, espremido entre os oitenta detentos, procurava desesperadamente uma luz no fim do túnel. Lembrava-se dos amigos influentes, de jornalistas, de políticos, e cada vez que Pássaro Azul o visitava, ele implorava que procurasse essas pessoas. Pássaro Azul corria atrás, mas sequer era recebida. Quem daria ouvidos a uma negra que se dizia íntima de Rossmarc, o biólogo que cometera crimes de biopirataria? Na visita seguinte, Rossmarc indagava:
— E dai, procurou aquela pessoa?
Para não magoar o amado, ela respondia que todos estavam muito interessados em sua causa. Dizia, entretanto, sem entusiasmo, com os olhos acuados e baixos, para não ver o rosto magro e chupado de Rossmarc. Entregava-lhe o pouco dinheiro que economizava, fruto da prostituição, e saia de lá com os olhos rasos d’água, tolhendo os soluços.
Numa noite no cabaré, Pássaro Azul conheceu um homem gordo e vesgo, que usava correntões de ouro. Dizia-se dono de um garimpo no meio da selva. Bebia e fumava muito, ria alto, com gargalhadas por vezes irritantes. Entre todas as raparigas, escolheu Pássaro Azul, que lhe fez todas as vontades, pervertendo-se de forma baixa e vil. Foram três noitadas intermináveis, mas Pássaro Azul aprendera a administrar a bebida. Não era tola, como as demais, que se embebedavam a ponto de caírem e serem arrastadas. Era carinhosa com o fazendeiro e saciava-lhe todos os caprichos. Não o abandonava, sentava em seu colo gordo e fazia-lhe agrados fingidos. Dava-lhe mais bebida e um composto de viagra, e o rosto gordo se avermelhava como de um leão enraivecido. Então, ela o puxava para o quarto sórdido. Na cama, enfrentava como guerreira o monte de carne e ossos, trepando sobre suas grandes papadas balofas e cavalgando, como uma guerreira. O homem resfolegava, gritava, gemia, uivava, mas Pássaro Azul não parava aquela louca cavalgada.
[...]
(GONÇALVES, David. Sangue verde. Joinville:
Sucesso Pocket, 2014. p. 217-218.)
O Texto 8 faz menção a crack. Sobre essa droga, leia o texto a seguir:
“O crack é obtido por meio de uma mistura de pasta de coca ou cloridrato de cocaína com bicarbonato de sódio (NaHCO3 ). A pasta de coca é um produto grosseiro, com muitas impurezas, obtido das primeiras fases de extração da cocaína das folhas da planta Erythroxylon coca, quando tratadas com bases fortes, com ácido sulfúrico e solventes orgânicos.
O crack é comercializado na forma de pequenas pedras porosas. Ele não é solúvel em água, mas os usuários o fumam aquecendo essas pedras em “cachimbos” improvisados, já que essa substância passa do estado sólido para o vapor a uma temperatura relativamente baixa, a 95ºC. Os vapores de cocaína liberados são absorvidos pelos pulmões quase imediatamente, pois o pulmão é um órgão intensamente vascularizado e com grande superfície. Assim, a cocaína é enviada para a circulação sanguínea e atinge o cérebro em 15 segundos.”
(Disponível em: www.brasilescola.com/quimica/quimica-crack.htm. Acesso em 26 jun. 2015. Adaptado.)
Assinale a única alternativa correta com relação às substâncias citadas no trecho sobre o crack:
INSTRUÇÃO: Para responder à questão, analise o
texto e a tabela a seguir.
Os indicadores ácido-base são úteis para se obter informações sobre o pH de soluções. Alguns, como o extrato de repolho roxo, podem ser preparados facilmente por qualquer pessoa na cozinha. Outros, como o tornassol, a fenolftaleína e o alaranjado de metila, são mais usados em laboratórios. Eles apresentam uma cor em pH ácido, outra cor em pH básico, e tonalidades intermediárias em uma faixa limitada de pH (faixa de mudança de cor), conforme pode ser observado na tabela.

De acordo com as informações acima, é correto afirmar:
A tira tematiza a contribuição da atividade humana para a deterioração do meio ambiente. Do diálogo apresentado, pode-se depreender que os ursos já sabiam

A solubilidade desse composto a 25.0°C, em água pura e em uma solução de pH igual a 13.00, será, respectivamente, em molL-1 :
PCl3(g) + Cl2(g) PCl5(g)
Sob essas condições, o efeito causado sobre a referida reação é:
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio

A concentração máxima permitida para fenóis em águas
não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a
concentração máxima permitida para fenóis pela resolução
n° 357 do CONAMA é de 0,003 mg/L.
Os químicos do laboratório de análises de uma indústria de tintas prepararam cinco amostras, cada uma com 1000 mL de efluente do processo, contendo fenol. A quatro delas, adicionaram – a cada uma separadamente – 0,1 mol das seguintes substâncias: KBr, NaCl, NaOH, HCl. A quinta amostra foi mantida apenas com o efluente. Após esse procedimento, fizeram análises da concentração de fenolato, C6 H5 O– , por instrumento de medida, em cada uma das cinco amostras.
Ao final dessa pesquisa, os químicos concluíram corretamente que a amostra que apresentou maior concentração de íon fenolato, dentre as cinco, foi aquela contendo