Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A adição de um catalisador na reação II, em equilíbrio, favorece o rendimento em H2
.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Uma diminuição de pressão favorece a formação de CO2
na reação I.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A constante de equilíbrio para a reação II, a 298K, é 1,05.10–5.
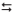 NH4(aq) + OH−
(aq) , assinale a alternativa que
apresenta a concentração do íon OH−
em mol/L e o pH da
solução nas condições dadas. Considere que para o
hidróxido de amônio Kb=1,0x10-5.
NH4(aq) + OH−
(aq) , assinale a alternativa que
apresenta a concentração do íon OH−
em mol/L e o pH da
solução nas condições dadas. Considere que para o
hidróxido de amônio Kb=1,0x10-5.Uma amostra dessa mistura gasosa, com volume total de 30 L, sob temperatura de 27 ºC e pressão de 1 atm, ao reagir com a solução aquosa de Ba(OH)2 , produz a precipitação de 98,5 g de BaCO3 . A fração gasosa remanescente, nas mesmas condições de temperatura e pressão, contém apenas CH4 .
Carbonato de cobalto é um sal muito pouco solúvel em água e, quando saturado na presença de corpo de fundo, a fase sólida se encontra em equilíbrio com os seus íons no meio aquoso.
CoCO3(s) ⇌ Co2+(aq) + CO32-(aq)
Sendo o produto de solubilidade do carbonato de cobalto, a 25 oC, igual a 1,0 x 10-10, a solubilidade do sal, em mol L-1, nessa temperatura é
CO2(g), dissolvido em água, H2CO3 no meio aquoso, e HCO3-, no meio aquoso, encontram-se em equilíbrio de acordo com as representações abaixo:
(I) CO2(aq) + H2O
 H2CO3 (aq)
(II) H2CO3(aq) + H2O
H2CO3 (aq)
(II) H2CO3(aq) + H2O HCO3-(aq) + H3O+(aq)
HCO3-(aq) + H3O+(aq)(III) HCO3- (aq) + H2O
 CO32-(aq) + H3O+(aq)
CO32-(aq) + H3O+(aq)Sobre esse comportamento é correto afirmar que:
(Adaptado: Revista Mundo Estranho, setembro de 2013. p. 49)
Para elevar o pH da água da chuva, pode-se adicionar a substância
(Adaptado: Revista Mundo Estranho, setembro de 2013. p. 49)
O índice normal da água, ou seja, pH = 7, a 25 °C, corresponde à concentração de íons OH− igual a
Dado: Kw, a 25 °C = 1,0 × 10−14
Essa solução apresenta pH elevado, aproximadamente 13, a 25°C, e que pode representar risco de queimadura ou sensação de forte ardência na boca, caso venha a ser ingerida.
Considerando o pH, a 25°C, da solução mencionada no texto, temos meio.
Dado: Produto iônico da água,
Kw=1,0• 10–14 , a 25°C.
Uma empresa alimentícia usou uma solução de hidróxido de sódio (soda cáustica) a 2,5% (m/v) para a limpeza de seus equipamentos.
Essa solução apresenta pH elevado, aproximadamente 13, a 25°C, e que pode representar risco de queimadura ou sensação de forte ardência na boca, caso venha a ser ingerida.
A solução de NaOH, descrita no texto, apresenta concentração em mol/L, aproximadamente, de.
De acordo com a figura e as informações do texto,infere-se que:

I. aquecimento de CaCO3 puro;
II. combustão de uma vela;
III. reação de raspas de Mg (s) com HCl (aq).
O aparecimento de coloração rosa nos cristais de CoCl2 anidro e a turvação da solução aquosa de Ca(OH)2 foram observados, simultaneamente, em


