Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
após adição de fenolftaleína, uma solução contendo CH3COONa torna-se incolor.
Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
a adição de um ácido forte a uma solução de ácido etanoico desloca o equilíbrio para a
formação do ânion etanoato.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

Com relação às informações acima, assinale a proposição CORRETA.
O monóxido de carbono, formado na combustão incompleta em motores automotivos, é um gás extremamente tóxico. A fim de reduzir sua descarga na atmosfera, as fábricas de automóveis passaram a instalar catalisadores contendo metais de transição, como o níquel, na saída dos motores.
Observe a equação química que descreve o processo de degradação catalítica do monóxido de carbono:
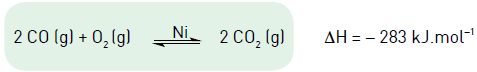
Com o objetivo de deslocar o equilíbrio dessa reação, visando a intensificar a degradação catalítica do monóxido de carbono, a alteração mais eficiente é:
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3 .
Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
X(g) + Y(g) ⇌ XY(g)
Considerando que as pressões iniciais de X e Y sejam respectivamente iguais a 3 atm e 2 atm e que a pressão total no equilíbrio seja igual a 4,2 atm, assinale a alternativa correta a respeito desta reação, nas condições indicadas:
Disponível em: (Adaptado) Acesso em 07 - jun-2011.
(Dados - massas molares: Na = 23g/mol; H = 1g/mol; O = 16g/mol; C = 12g/mol; S = 32g/mol)
De acordo com o texto e com os seus conhecimentos, é correto afirmar que:
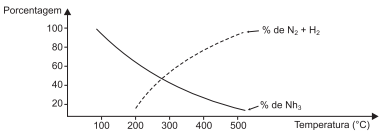
N2(g) + 3H2(g) 
O gráfico mostra a variação do rendimento de amônia com a
variação da temperatura de acordo com o sistema em equilíbrio
químico, a 100,0atm, representado pela equação termoquímica.
Uma análise desse gráfico e do sistema em equilíbrio químico representado pela equação termoquímica permite afirmar:
A partir da compreensão dessa informação, é correto afirmar:
(CoCl4) 2− (s) + 6H2O(l) [Co(H2O)6] 2+(aq) + 4Cl− (aq) ΔHº=−504kJ
As pequenas esferas azuis de sílica gel utilizadas como desumidificadores no transporte e na proteção de aparelhos eletroeletrônicos, em atmosfera úmida, absorve água do ambiente tornando-se cor de rosa. Ao serem aquecidas em uma estufa, voltam a ter a cor azul inicial de acordo com o sistema em equilíbrio químico representado pela equação química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+ + 3SO42-
O excesso de íons H+ formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+ é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
Com base nos dados da tabela, pode-se afirmar que apenas
CH3COOH(aq) + H2O(l) ⇌ CH3COO− (aq) + H+ (aq)
Equilíbrio iônico é o caso particular de equilíbrio químico em que aparecem íons. Os íons estão presentes em várias soluções aquosas encontradas na natureza e nos organismos dos seres vivos. Dos equilíbrios químicos iônicos em solução aquosa, um dos mais importantes é o que ocorre na ionização de ácidos e de bases. A concentração desses íons depende, entre outros fatores, do grau de ionização, α, e do valor da constante de ionização, Ka.
Desse modo, considerando-se uma solução de ácido acético 0,02 mol L−1 , cujo grau de ionização, α, é igual a 3%, em equilíbrio químico representado pela equação química, é correto afirmar:
I. FeCO3(s) + CO2(g) + H2O(l) ⇌ Fe2+(aq) + 2HCO-3 (aq)
II. 4Fe2+(aq) + 8HCO-3 (aq) + O2(aq) ⇌ 2Fe2O3(s) + 8CO2(g) + 4H2O(l)

As propriedades curativas atribuídas à água de Itaparica da Reserva Venceslau, — nome dado em homenagem a um dos primeiros ecologistas da Ilha de Itaparica, — são consequências da presença de íons Fe2+(aq) dissolvidos. Esses íons são responsáveis pela formação de depósitos de Fe2O3(s), de cor marrom, em pisos e azulejos, de acordo com o sistema em equilíbrio I e a equação química II.
A partir dessas informações e dessas equações, é correto afirmar:
Os óxidos de nitrogênio, NO(g) e NO2(g), são poluentes ambientais responsáveis pela formação de ozônio, O3(g), na baixa atmosfera, nos grandes centros urbanos. Em um determinado experimento realizado com esses gases, em recipiente fechado, a concentração de NO2(g), em função do tempo, apresentou o comportamento mostrado no gráfico.
Uma análise dessas informações e desse gráfico permite
afirmar:
Com o desenvolvimento da fotografia nos séculos XIX e XX, muitos estudos investigaram a química dos haletos de prata. Com isso, além do desenvolvimento tecnológico, avanços científicos foram alcançados no entendimento da formação de cristais e reações fotoquímicas envolvendo compostos iônicos. Na tabela a seguir são fornecidos dados de propriedades, como produto de solubilidade e de potencial padrão de redução, dos principais haletos de prata.
KPS (mol2 . dm-6) E0 (V)
AgX + e- → Ag0 + X-
AgCℓ 1,77 x 10-10 0,22233
AgBr 5,35 x 10-13 0,07133
Agl 8,52 x 10-17 -0,15224
Com relação aos haletos de prata, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) O cátion Ag+ possui maior afinidade por haletos de mais baixa razão carga:raio.
( ) Existe uma tendência clara: quanto menos solúvel é o haleto de prata, menos oxidante esse composto será.
( ) Numa amostra composta por uma mistura de cloreto, brometo e iodeto de prata, e um forte agente redutor, a primeira espécie a reduzir será o Agl.
( ) Ao se adicionar 1 mol de um haleto de prata sólido (representação genérica: AgX) numa solução aquosa 1,0 mol.dm-3 do respectivo haleto de potássio (representação genérica: KX), a máxima quantidade de íons prata em solução será inferior a ppb (partes por bilhão).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Cultura: Arroz | pH médio: 5,0 Cultura: Café | pH médio: 6,0 Cultura: Milho | pH médio: 7,0
Daí a necessidade, em muitas ocasiões, de corrigir o pH do solo com a adição de calcário (carbonato de cálcio). Sobre a correção do solo e o cultivo dos alimentos, assinale a alternativa correta.