Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
A reação de escurecimento em frutas, vegetais e sucos de frutas é um dos principais problemas na indústria de alimentos. Estima-se que em torno de 50% da perda de frutas tropicais no mundo é devida à enzima polifenol oxidase – PFO, que provoca a oxidação dos compostos fenólicos naturais presentes nos alimentos, causa a formação de pigmentos escuros – frequentemente acompanhados de mudanças indesejáveis na aparência e nas propriedades organolépticas do produto – resultando na diminuição da vida útil e do valor de mercado.
Várias maneiras de inibição da polifenol oxidase são conhecidas. Essa inibição é desejável e muitas vezes necessária para evitar o aparecimento de sabor desagradável e toxidez, como também por questões econômicas. Três componentes devem estar presentes para que a reação de escurecimento enzimático ocorra: enzima, substrato e oxigênio. No caso de ausência ou bloqueio da participação de um destes na reação química (seja por agentes redutores, diminuição de temperatura ou abaixamento de pH), a “velocidade” de reação diminui significativamente. O pH ótimo de atuação da PFO está entre 6 e 7, e abaixo de 3 não há nenhuma atividade enzimática.”
Adaptado de CARVALHO; LUPETTI; FATIBELLO-FILHO. Química Nova na Escola, n. 22, 2005.
A partir da leitura do texto acima e considerando as contribuições da ciência e tecnologia no campo da produção alimentícia, assinale a alternativa correta.
Determinou-se experimentalmente as concentrações de íons H+ e de íons OH- na água pura, no vinagre e em uma solução de limpeza com amônia, todos a 25˚C, obtendo-se os seguintes dados:
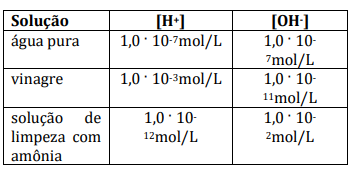
Assinale a alternativa correta.
H2(g) + I2(g)
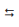 2HI(g)
2HI(g)
Que alterações farão variar a constante de equilíbrio da reação entre o H2(g) e o I2(g)?
I adição de um catalisador II aumento da pressão (temperatura constante) III aumento da concentração dos reagentes IV aumento da temperatura V aumento da concentração dos produtos
Quando borbulhado em água, o H2S comporta-se como ácido fraco, estabelecendo-se os equilíbrios simultâneos representados pelas equações a seguir:
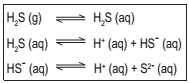
Dentre os procedimentos a seguir, o único que provoca um aumento do escape de sulfeto de hidrogênio de uma solução aquosa para o ar é
I. Quando dissolvidos em água, os gases CO2, SO2, SO3 e HCl geram soluções eletrolíticas cujo pH é menor que 7.
II. As moléculas de CO2, SO2 e H2O apresentam geometria linear.
III. No estado sólido, as moléculas de CO2 encontram-se atraídas entre si por ligações de hidrogênio muito intensas.
É correto o que se afirma em:
CO2 (aq) + H2O (l)
 H+ (aq) + HCO3– (aq)
H+ (aq) + HCO3– (aq)A diminuição do pH do sangue constitui a acidose, que provoca náusea, vômito e cansaço. O aumento do pH do sangue corresponde à alcalose, que provoca distúrbios respiratórios, cãibras e convulsões. Considere as seguintes afirmações:
I. Pessoas com deficiência respiratória não exalam CO2 suficientemente, com o que a reação deste com H2O se desloca para a esquerda.
II. Pessoas ansiosas respiram rapidamente, eliminando muito CO2 , com o que a reação deste com H2O se desloca para a esquerda.
III. Pessoas com diarreia sofrem grande perda de íons bicarbonato, com o que a reação do CO2 com H2O se desloca para a direita.
É correto o que se afirma em:

Pela análise do texto, é correto afirmar que
• Os sólidos foram misturados com água, em recipientes separados, e verificou- se que o de número 2 não dissolveu.
• As duas soluções obtidas foram testadas em relação à condutibilidade elétrica, e apenas a obtida pela dissolução do sólido número 3 resultou condutora.
Os resultados permitem concluir que os sólidos 1, 2 e 3 são, respectivamente,
Três amostras líquidas, identificadas pelas letras A, B e C, foram testadas por meio de indicadores ácido- base. Os resultados são apresentados no quadro a seguir:
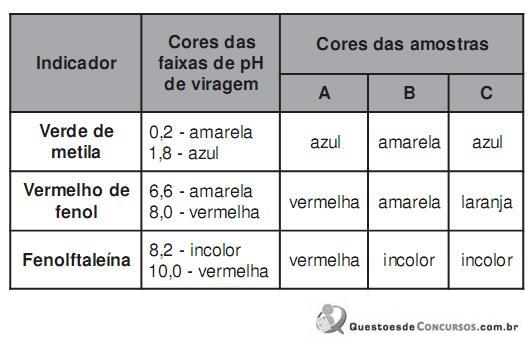
A análise dos resultados permite concluir que as amostras A, B e C são, respectivamente,

I. Reduzir o volume do recipiente para 10 L. A constante de equilíbrio desse sistema é designada KP (I).
II. Aumentar a temperatura do frasco para 100 C. A constante de equilíbrio desse sistema é designada KP (II) Comparando-se as constantes de equilíbrio KP(I) e KP(II) com a constante de equilíbrio no sistema inicial observa-se que:

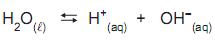
O produto iônico da água é
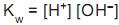 , cujo valor é 1 x
, cujo valor é 1 x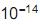 a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a
a 25 °C. Ao se adicionar 1,0 mL de NaOH 1,0 mol/L (base forte) a um copo bécher contendo 99 mL de água pura, o pH da solução será aproximadamente igual a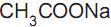 ) e ácido acético (
) e ácido acético (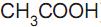 ). O pH desse tampão pode variar de 4,0 a 5,4 de acordo com a proporção dessa mistura.
). O pH desse tampão pode variar de 4,0 a 5,4 de acordo com a proporção dessa mistura. Sobre o tampão acetato, é ERRADO afirmar que:
 . Sabendo que as concentrações de N2 e O2 no equilíbrio acima, a 800 °C, são iguais a 0,10 mol L-1 para ambos, calcule a concentração molar de NO no equilíbrio se K = 4,0 x 10-20 a 800 °C.
. Sabendo que as concentrações de N2 e O2 no equilíbrio acima, a 800 °C, são iguais a 0,10 mol L-1 para ambos, calcule a concentração molar de NO no equilíbrio se K = 4,0 x 10-20 a 800 °C.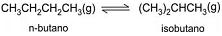
é atingido após certo tempo, sendo a constante de equilíbrio igual a 2,5. Nesse processo, partindo exclusivamente de 70,0 g de n-butano, ao se atingir a situação de equilíbrio, x gramas de n-butano terão sido convertidos em isobutano. O valor de x é
Analise as proposições a seguir:
I. Um dos componentes mais importantes do xampu são os surfactantes, substâncias responsáveis pela eliminação da oleosidade, atuando pela interação entre a gordura, o xampu e a água mediante ligações intermoleculares.
II. Para garantir o pH do xampu por volta de 6, valor próximo ao pH do cabelo, o ácido cítrico pode ser utilizado, o que indica que nestes produtos a concentração hidrogeniônica é da ordem de 1,0 x 10-6 mol/L.
III. Os xampus destinados ao uso infantil contêm surfactantes-anfotéricos (estrutura a seguir), que em meio ácido captura o íon H+ , e em solução básica liberam um dos hidrogênios ligados ao nitrogênio, o que os tornam menos irritantes aos olhos.
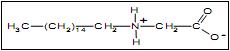
IV. Ao utilizarmos um xampu formado por surfactante aniônico, e não enxaguarmos adequadamente para remover todo o produto usado na lavagem, parte desse ficará aderida aos cabelos e o atribuirão cargas negativas que causam repulsão entre eles, sendo indicado para diminuir essa repulsão, o uso de condicionadores por apresentarem na sua composição substâncias com cargas positivas.
É CORRETO o que se afirma em:
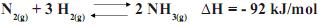
Sobre o equilíbrio do processo acima, é CORRETO afrmar que