Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões

Sabendo-se, então, que o coeficiente de solubilidade do K2Cr2O7 é de 12,0 gramas em 100 mL de água à T=200 C, que tipo de sistema será formado quando forem adicionadas 120 gramas de K2Cr2O7 em 600 mL de água à T=200 C?

Considerando-se, por exemplo, que um solo ideal para a cultura da soja necessite de um pH= 5,0, este solo possuirá uma concentração de íons Hidrogênio (H+ ) e pOH, respectivamente iguais a:
Se o bicarbonato de sódio (NaH2CO3), principal constituinte de alguns tipos de extintores de incêndio, for obtido a partir da reação exotérmica de neutralização, conforme equilíbrio químico representado pela equação H2CO3(aq) + NaOH(aq)
 NaHCO3(aq) + H2O(l)
NaHCO3(aq) + H2O(l)então o rendimento da reação seria maior se a temperatura aumentasse e o pH diminuísse.
Na tabela a seguir, são apresentadas informações contidas na bula de comprimidos sólidos de ibuprofeno.
cada comprimido contém
ibuprofeno____|___ 300 mg
excipientes ___|___ ácido cítrico, benzoato de sódio,dióxido de titânio e amido
Assinale a opção que apresenta o gráfico que melhor representa a variação da temperatura em função do tempo para um comprimido que tenha a composição mostrada na tabela e tenha sido macerado e aquecido.
Caso pKa = - log Ka , em que Ka é a constante de dissociação ácida do AAS, seja igual a 3,5, então a aspirina será mais bem absorvida pelo epitélio do estômago, onde o pH médio é 2, que pelo duodeno, onde o pH médio é 8.
Sabe-se que o pH de alvejantes formados por soluções aquosas de hipoclorito de sódio é superior a 7. Isso se deve ao fato de o NaClO, ao reagir com a água, produzir o ácido hipocloroso (HClO), o que aumenta a razão [OH- ]/[H3O+ ] no meio.
A reação de produção do amoníaco, conhecida como Processo Haber-Bosch é:
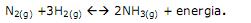
Sobre a formação do amoníaco, considerando apenas as informações fornecidas pela equação acima, e sobre os constituintes do Ziklon B, é correto afirmar-se que

30 60
50 70
Para dissolver 40 g desse sal à 50 °C e 30 °C, as massas de água necessárias, respectivamente, são:
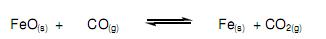
I. Aumentando a concentração de CO(g) o equilíbrio se desloca para a direita.
II. Aumentando a concentração de CO(g) o equilíbrio não é alterado.
III. Retirando CO(g) o equilíbrio se desloca para a esquerda.
IV. À adição de CO2(g) o equilíbrio se desloca para a esquerda.
V. A adição de uma substância desloca o equilíbrio no sentido que irá consumi-la.
VI. O equilíbrio só se desloca no sentido da formação dos produtos.
Assinale a alternativa correta.
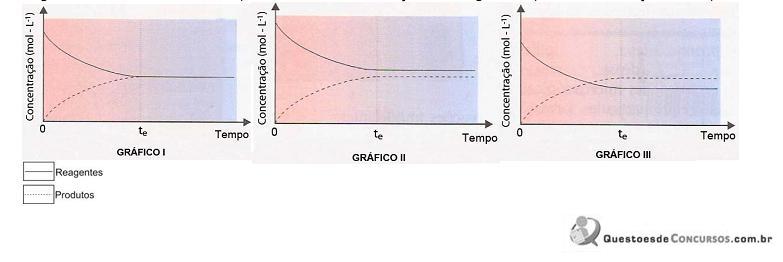
As informações apresentadas na figura permitem concluir que o equilíbrio químico está deslocado no sentido dos reagentes no(s) gráfico(s)
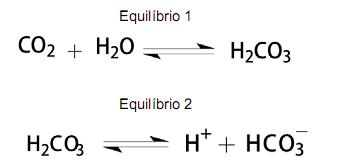
Sobre o sangue e o seu sistema tamponado, é CORRETO afirmar:
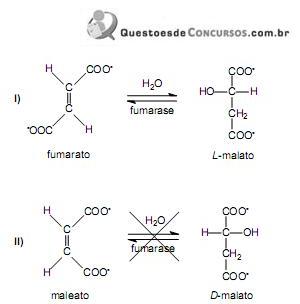
A reação representada em II não ocorre porque
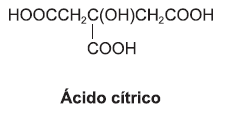
O ácido cítrico, responsável pela acidez das frutas cítricas, é utilizado como acidificante e flavorizante no processamento de alguns alimentos.
A partir dessas informações, é correto afirmar:
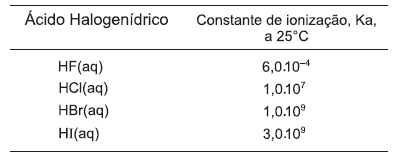
A tabela relaciona os valores da constante de ionização, Ka, dos ácidos halogenídricos.
A partir da análise dessa tabela, é correto afirmar:
Em um recipiente de 2,0L, foram misturados 12,0mol de dióxido de enxofre, SO2(g), com 10,0mol de oxigênio, O2(g), à determinada temperatura. Após ter sido fechado o recipiente, e depois de estabelecido o equilíbrio químico, o sistema, representado pela equação química, apresentou 8,0mol de trióxido de enxofre, SO3.
A partir dessas informações e da análise do equilíbrio químico do sistema considerado, é correto afirmar:
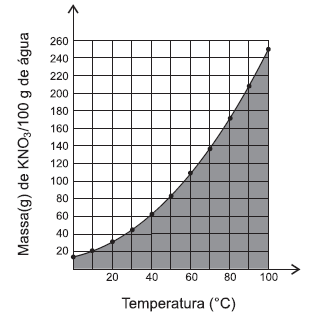
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
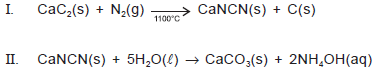
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100°C, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:



