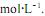Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
Um técnico de laboratório distraído preparou solições de carbonato de potássio (K2CO3),
hidróxido de sódio (NaOH) e de hidróxido de cálcio (Ca(OH)2), colocando- se em três frascos não rotulados ( frascos X, Y E Z ).
Para identificar as soluções, um aluno misturou, em três tubos de ensaio distintos,
amostras de cada frasco com solução aquosa de ácido clorídrico. Nada foi observado nas soluções dos frascos X e Z, mas ocorreu uma efervenscência no
tuboque continha a solução do frasco Y.
Em seguida, o aluno combinou, dois a dois, os conteúdos de cada frasco ( frasco X, Y e Z ) em tubos de ensaios limpos.
Observou que só houve formação de precipitado quando misturou as soluções dos frascos X e Y.
Assinale a alternativa que identifica corretamente o conteúdo dos frascos X, Y e Z.
I. A adição de algumas gotas de fenolftaleína a amostras de cada solução fez com que apenas a amostra de B se tornasse rosada.
II. A solução rosada, obtida no ensaio I, tornou-se incolor pela adição de amostra de A.
III. Amostras de A e C produziram precipitados brancos quando misturadas, em separado, com amostras de D.
Com base nessas observações e sabendo que sulfatos de metais alcalino-terrosos são pouco solúveis em água, pode-se concluir que A, B, C e D são, respectivamente, soluções aquosas de
Frasco 1: 100 mL de H2O( L )
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de
 de concentração 1,2 mol/L
de concentração 1,2 mol/L
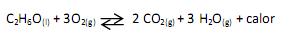
A partir desta reação, é correto afirmar que:
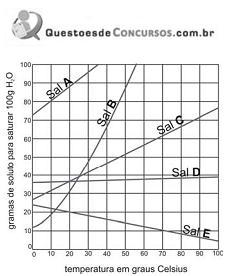
O gráfico acima mostra a curva de solubilidade para diversos sais inorgânicos. A análise do gráfico permite concluir que a quantidade mínima de água, em gramas, a 10 ºC, necessária para dissolver 16 g do sal A é igual a:
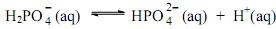
Se no equilíbrio foram medidas as concentrações molares
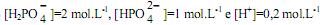 , o valor da constante de equilíbrio é:
, o valor da constante de equilíbrio é: NaOH 5,6 mol.L-1 e ao qual foi adicionado 150 mL de uma solução de HCl 2,0 mol.L-1 . A solução resultante dessa mistura deverá apresentar um pH:
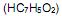 com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio
com o hidróxido de sódio. Se em uma solução aquosa 0,072 mol/L de ácido benzóico, no equilíbrio apresenta uma concentração de íons hidrônio 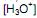 de 2,1 x 10-3 mol/L, qual é o valor de
de 2,1 x 10-3 mol/L, qual é o valor de 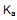 (constante de ionização ácida) deste ácido?
(constante de ionização ácida) deste ácido?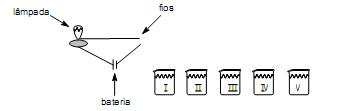
Sabe-se que, no caso dos ácidos, quanto maior o grau de ionização, maior a intensidade da luz emitida pela lâmpada. Ao se realizar o teste de condutividade com as cinco soluções de mesma concentração, preparadas com ácidos (I, II, III, IV e V), observaram-se diferentes intensidades luminosas, ao se mergulhar os fios nas soluções. Considere os seguintes valores de pKa para os ácidos.
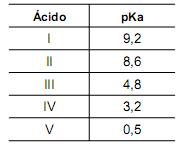
Analisando-se os dados de pKa, conclui-se que a maior luminosidade foi observada quando os fios foram colocados na solução do ácido
Durante a Primeira Guerra Mundial, um bloqueio naval britânico impediu, estrategicamente, a remessa de salitre-do-chile para a Alemanha. Esse material, vindo de uma região desértica do norte do Chile, era partida para produção de explosivos, pois contém nitrato de sódio (NaNO3) , e era também responsável por dois terços da fabricação de fertilizantes no mundo, o que poderia prejudicar a produção de alimentos à época. A solução para tais problemas foi encontrada pelos trabalhos dos químicos alemães Fritz Haber e Carl Bosch, através de um processo onde são usados o nitrogênio atmosférico e o gás hidrogênio para produzir amoníaco (NH3), de forma economicamente viável, para a substituição do salitre. A equação química que representa esse processo é:
N2(g) + 3H2(g) ⇌ 2 NH3(g); ΔH < 0
Contudo, considerando em um determinado instante que o sistema esteja em equilíbrio, a produção de amoníaco será aumentada se:
Sendo assim, para produzir a toxina botulínica, em um meio de cultivo dessas bactérias, a concentração de íons H+ deve estar entre
perfeitamente vedada. Mais do que uma cela, tratava-se de um
laboratório. Um homem, jovem, estava sentado, preso em uma
cadeira. Uma grande abertura envidraçada permitia ver tudo. Ao
meio-dia e doze, pequenas bolas de cianeto de potássio (KCN)
caíram em um recipiente sob o assento, onde havia uma mistura
de ácido sulfúrico e água. Imediatamente, o gás envenenado
(HCN) começou a espalhar-se pelo ambiente. O homem começou
a tossir, a sufocar. Em poucos minutos, sua cabeça pendeu.
Tossiu, novamente, mais forte, ergueu a cabeça pela última vez
e desabou. Ao meio-dia e trinta, os médicos que supervisionavam
os instrumentos de controle declararam que o condenado Walter
LaGrands estava clinicamente morto. Ele tinha trinta e sete anos.
Nascera em Augsbourg, na Alemanha, como seu irmão Karl. A
mãe deles casara-se com um soldado americano, destacado para
servir na Alemanha, e depois partiu para os EUA com seus dois
filhos. Em 1982, em uma tentativa de roubo a mão armada a um
banco no Arizona, os irmãos LaGrands mataram um funcionário
e feriram outro. Eles tinham, à época, vinte e dezoito anos.
Ambos foram condenados à pena capital. Passaram dezesseis
anos no corredor da morte. Depois de ter o último recurso
negado, Karl solicitou ser executado com uma injeção letal.
Walter recusou. Era sua última cartada: já que a justiça americana
decidira que ele deveria morrer, que ela, então, matasse esse
cidadão alemão na câmara de gás. Talvez Walter pensasse que a
governadora do Arizona, Jane Hall, ante a dimensão simbólica
desse ato, pudesse recuar. Enganou-se. No dia 3 de março, Walter
foi levado à câmara de gás.
Robert Badinter. Contre la peine de mort. Écrits 1970-2006.
Paris: Fayard, 2006, p. 249-50 (tradução com adaptações).
A partir do texto, considerando os diferentes aspectos que ele
suscita e sabendo que as massas atômicas do hidrogênio, enxofre
e oxigênio são iguais, respectivamente, a 1, 32,1 e 16, julgue os
itens
perfeitamente vedada. Mais do que uma cela, tratava-se de um
laboratório. Um homem, jovem, estava sentado, preso em uma
cadeira. Uma grande abertura envidraçada permitia ver tudo. Ao
meio-dia e doze, pequenas bolas de cianeto de potássio (KCN)
caíram em um recipiente sob o assento, onde havia uma mistura
de ácido sulfúrico e água. Imediatamente, o gás envenenado
(HCN) começou a espalhar-se pelo ambiente. O homem começou
a tossir, a sufocar. Em poucos minutos, sua cabeça pendeu.
Tossiu, novamente, mais forte, ergueu a cabeça pela última vez
e desabou. Ao meio-dia e trinta, os médicos que supervisionavam
os instrumentos de controle declararam que o condenado Walter
LaGrands estava clinicamente morto. Ele tinha trinta e sete anos.
Nascera em Augsbourg, na Alemanha, como seu irmão Karl. A
mãe deles casara-se com um soldado americano, destacado para
servir na Alemanha, e depois partiu para os EUA com seus dois
filhos. Em 1982, em uma tentativa de roubo a mão armada a um
banco no Arizona, os irmãos LaGrands mataram um funcionário
e feriram outro. Eles tinham, à época, vinte e dezoito anos.
Ambos foram condenados à pena capital. Passaram dezesseis
anos no corredor da morte. Depois de ter o último recurso
negado, Karl solicitou ser executado com uma injeção letal.
Walter recusou. Era sua última cartada: já que a justiça americana
decidira que ele deveria morrer, que ela, então, matasse esse
cidadão alemão na câmara de gás. Talvez Walter pensasse que a
governadora do Arizona, Jane Hall, ante a dimensão simbólica
desse ato, pudesse recuar. Enganou-se. No dia 3 de março, Walter
foi levado à câmara de gás.
Robert Badinter. Contre la peine de mort. Écrits 1970-2006.
Paris: Fayard, 2006, p. 249-50 (tradução com adaptações).
A partir do texto, considerando os diferentes aspectos que ele
suscita e sabendo que as massas atômicas do hidrogênio, enxofre
e oxigênio são iguais, respectivamente, a 1, 32,1 e 16, julgue os
itens
 na solução era menor que 1,0 × 10-2
na solução era menor que 1,0 × 10-2