Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
(F): 6H2O + 6CO2 ⇌ C6H12O6 + 6O2
(R): C6H12O6 + 6O2 ⇌ 6H2O + 6CO2
Sabendo-se que a fotossíntese só ocorre em presença de luz, pode-se afirmar que a concentração de
A concentração de CO2 na atmosfera vem aumentando nos últimos anos. Segundo os cientistas, o aumento da quantidade desse gás que é dissolvida no oceano pode prejudicar particularmente os corais e as espécies que têm conchas duras.
O equilíbrio do CO2 em solução aquosa pode ser representado pelas seguintes etapas:
CO2 (g) ⇌ CO2 (aq) (1)
CO2 (aq) + H2O (l) ⇌ H2CO3 (aq) (2)
H2CO3 (aq) ⇌ HCO3 - (aq) + H+ (aq) (3)
A dissolução do CO2 no oceano provoca
Nestas fguras, estão representados, esquematicamente, os materiais então utilizados por eles:
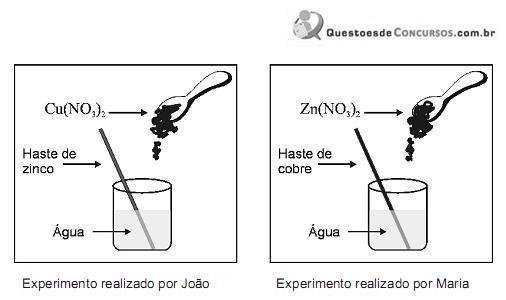
Para facilitar a dissolução de nitrato de cobre em água, João usou uma haste de zinco. No fnal do experimento, a haste estava corroída e formou-se uma solução incolor e um sólido, que, após algum tempo, se depositou no fundo do recipiente.
Maria, por sua vez, utilizou uma haste de cobre para dissolver nitrato de zinco em água. No fnal do experimento, ela obteve uma solução incolor e a haste manteve- se intacta.
Sabe-se que as soluções aquosas de nitrato de cobre (II),
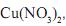 são azuis e que as de nitrato de zinco (II),
são azuis e que as de nitrato de zinco (II), 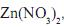 são incolores.
são incolores. Considerando-se os dois experimentos descritos, é CORRETO afrmar que
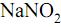 é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.
é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.Dada a constante de hidrólise:
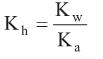
e considerando as constantes de equilíbrio
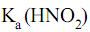 = 5 × 10–4 e
= 5 × 10–4 e 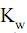 = 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a
= 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a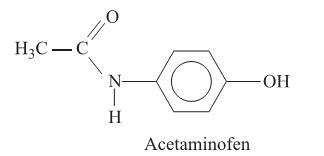
Considere a figura com a estrutura do acetaminofen e as seguintes afirmações:
I. O acetaminofen apresenta fórmula molecular
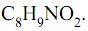
II. O grupo funcional amida é que confere o caráter básico do acetaminofen.
III. A absorção do ácido acetilsalicílico em um indivíduo é maior no estômago do que no intestino, devido ao baixo pH do suco gástrico.
IV. Os fenóis apresentam menor acidez do que os ácidos carboxílicos.
São corretas as afirmações
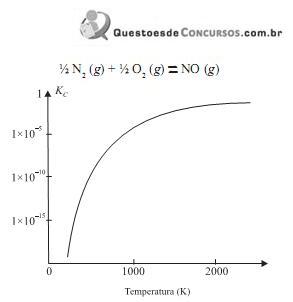
Considere as seguintes afirmações:
I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em
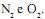
II. O aumento da pressão favorece a formação do NO.
III. A 2400 K há maior quantidade de NO do que a 1200 K. IV. A reação de formação do NO é endotérmica.
São corretas as afirmações contidas somente em
Sabe-se que, no equilíbrio, a velocidade de formação dos produtos, V, e a velocidade inversa, de formação dos reagentes, V’ , são iguais:
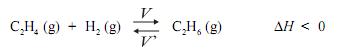
Foram realizados dois experimentos envolvendo essa reação, com apenas uma diferença: um, na presença de catalisador; o outro, na ausência deste.
Comparando-se esses dois experimentos, é CORRETO afirmar que, na reação catalisada, aumenta
PbS (s) ⇄ Pb2- (aq) + S2- (aq) S2- (aq) + 2 H- (aq)⇄ H2S (aq)
Neste gráfico, estão representadas as concentrações de Pb 2+ e S 2– , originadas exclusivamente do PbS, em função do pH da água:
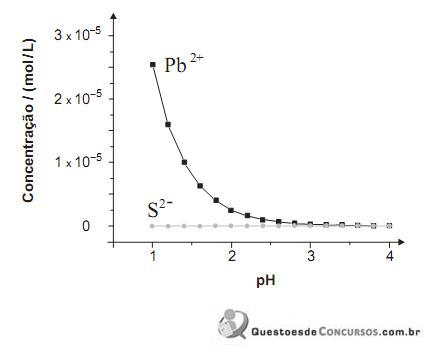
Considere que a incidência de chuva ácida sobre o mesmo lago altera a concentração das espécies envolvidas nos dois equilíbrios.
Com base nessas informações, é CORRETO afirmar que, na situação descrita,
Nos três casos, ocorreu reação química e observou-se a formação de bolhas.
Ao final das reações, as três soluções tornaram-se cor-de-rosa.
O tempo necessário para que cada uma dessas reações se complete está registrado neste quadro:
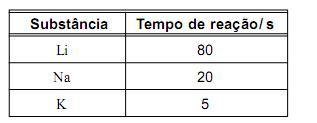
Considerando-se essas informações, é INCORRETO afirmar que
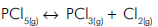
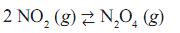
Quando esse recipiente é colocado em um banho de água e gelo, o gás torna- se incolor. Em relação a esse sistema, são feitas as seguintes afirmações:
I. A reação no sentido da formação do gás incolor é exotérmica.
II. Com o aumento da pressão do sistema, a cor castanha é atenuada.
III. Quando o sistema absorve calor, a cor castanha é acentuada.
Dentre as afirmações, as corretas são:
