Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
Considere a tirinha a seguir.

Apl icada ao equi líbrio químico, a idéia que o personagem tem sobre equi líbrio
I - Colocando-se, em água, uma quantidade de sal superior à sua solubilidade, obtém-se uma solução saturada em equilíbrio com a porção do sal não dissolvida, formando um sistema homogêneo. II - Detecta-se experimentalmente que as concentrações dos íons H3O+ e OH− para as soluções salinas podem ou não ser alteradas em relação às da água pura e que soluções de cloreto de amônio (NH4Cl) são alteradas, com a concentração de H3O+ aumentando e de OH− diminuindo, assim, tem-se que soluções de cloreto de amônio são ácidas. III - Sais que formam soluções básicas têm um ânion capaz de reagir com a água, alterando, para maior, a concentração do íon OH− . IV - A reação de hidrólise de qualquer sal ocorre sempre com a formação de um ácido ou uma base fraca.
Estão corretas as afirmativas

Em um processo de limpeza, quantidades iguais de água sanitária foram adicionadas a volumes iguais de líquidos com diferentes valores de pH a 25 ºC, de acordo com a tabela.

O chumbo pode ser encontrado em uma grande quantidade de tintas em forma de sais e óxidos, dentre os quais o cromato de chumbo (amarelo) e o tetróxido de trichumbo (vermelho). Uma reação de identificação do íon Pb(II) é sua precipitação em meio aquoso, que consiste na conversão de um composto de chumbo relativamente solúvel em um composto praticamente insolúvel.
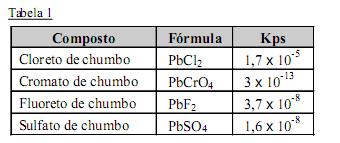
Com base nas informações acima escolha a alternativa que contém a substância mais indicada para a identificação do chumbo II por precipitação em meio aquoso. Considere que todos os sais de metais alcalinos são muito solúveis em água.

A diminuição da concentração de oxigênio nas redondezas da célula:

Nesse caso, a substância responsável por essa mudança de coloração é o cloreto de cobalto,
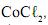 que, de acordo com a situação, apresenta duas cores distintas — azul ou rosa —, como representado nesta equação:
que, de acordo com a situação, apresenta duas cores distintas — azul ou rosa —, como representado nesta equação: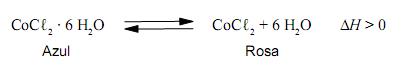
Considerando-se essas informações, é CORREtO afrmar que as duas condições que favorecem a ocorrência, no “galinho do tempo”, da cor azul são
Analise estas três afrmativas concernentes a esse sistema:
I. O sistema é ácido.
II. O pH do sistema é maior que 7.
III. No sistema, a concentração dos íons H+ é maior que a dos OH– .
A partir dessa análise, é CORREtO afrmar que

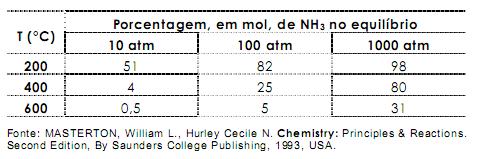
As condições econômicas aceitáveis, para se produzir amônia industrialmente, são: pressão acima de 100 atm, temperatura em torno de 450°C e u so de um catalisador.
Com base em todas essas informações, pode-se afirmar:

O gráfico abaixo representa a modificação que acontece nas concentrações dos reagentes e produto, após uma perturbação do equilíbrio no tempo t1
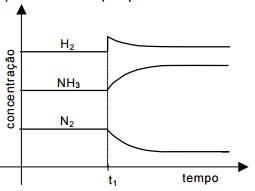
De acordo com o gráfico, essa perturbação poderia ser causada por


Considerando essas informações, julgue os itens seguintes.
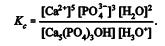

Considerando essas informações, julgue os itens seguintes.

Considerando essas informações, julgue os itens seguintes.

Acerca dos temas tratados no texto, julgue os itens que se
seguem

Com base nessas informações e sabendo que, nas expressões
apresentadas, k é uma constante real a ser determinada, julgue os
itens subseqüentes
 .
.( a resposta é 690 )


Com base nas informações do texto, julgue os itens de 19 a 33.
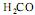 produzido na reação II tem grupo funcional ácido que, em meio aquoso, diminui o pH da água e produz o íon HCO .
produzido na reação II tem grupo funcional ácido que, em meio aquoso, diminui o pH da água e produz o íon HCO .Considere a reação simplificada da síntese do Ácido Acetilsalicílico:
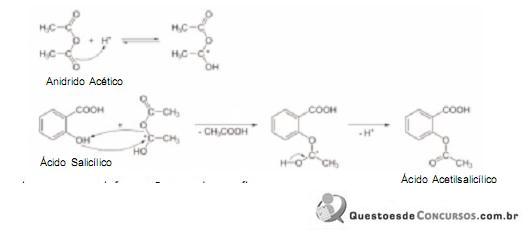
Com base nessas informações, pode-se afirmar que:
I o pH de uma solução 0,0010 M de Ácido Acetilsalicílico é igual a 11,00;
II na reação mostrada, o pH da solução está abaixo de 7,00;
III uma hidrólise no grupo funcional éster do Ácido Acetilsalicilíco com excesso de
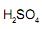 origina uma solução de pH acima de 7,00;
origina uma solução de pH acima de 7,00; IV um isômero do Ácido Salicílico é o Ácido Meta-Hidroxibenzóico;
V na fórmula estrutural do Ácido Acetilsalicílico todos os átomos de Carbono são trigonais planares.
Assinale a opção correta.
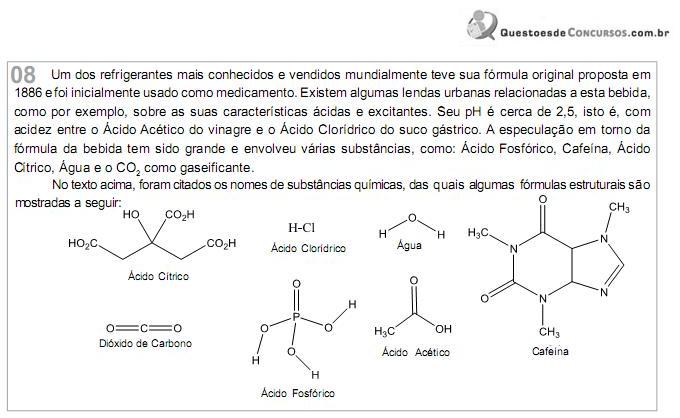
Com relação às substâncias químicas mencionadas no quadro da própria questão, assinale a opção correta.
Dentre os equilíbrios químicos,
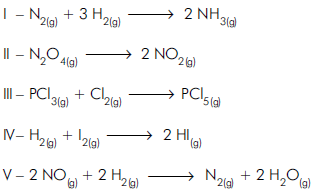
aquele com Kp = Kc é o
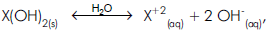
tem um pH = 10, a 25°C. O produto de solubilidade do X(OH)2 é