Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 634 questões

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
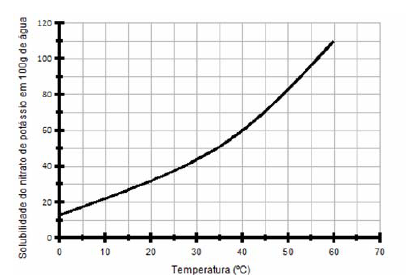
Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)
Queixas chegaram à Vigilância Sanitária Estadual e foram relatadas por moradores de Canoas, São Leopoldo e Porto Alegre
Na zona sul da Capital, uma menina de 10 anos foi levada ao Hospital de Pronto Socorro (HPS) depois que sentiu uma forte ardência na boca e na garganta ao beber o produto, comprado pela avó dela, que é dona de um minimercado no bairro Guarujá. A garota foi medicada e retornou para casa nesta tarde. Segundo a responsável pelo setor de alimentos da Divisão de Vigilância Sanitária do Estado, Susete Lobo Saar de Almeida, uma análise laboratorial prévia do produto constatou alterações no pH da bebida. Esse índice, que aponta o quanto uma substância é ácida ou alcalina, estaria em torno de 13 — em uma escala que vai de zero a 14 — indicando grande alcalinidade no produto.
Fonte: http://zerohora.clicrbs.com.br
Qual das substâncias abaixo poderia ter causado o problema citado na reportagem?
Concentração de ácido acético: 6,0% m/V
Ao explicar que o vinagre é uma solução aquosa de ácido acético (ácido etanóico), o professor deixou o seguinte questionamento valendo um ponto na média: “Qual o pH do vinagre?” As seguintes informações foram fornecidas pelo professor:
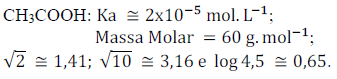
Assim, ganhará o ponto o aluno que responder que o pH é aproximadamente:
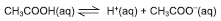
Dos sistemas em equilíbrio químico iônico em solução aquosa, um dos mais importantes é o que ocorre na ionização de ácidos e de bases, como o representado pela equação química, em que o ácido acético, em solução aquosa 0,1 mol.L–1, está 1,0% ionizado, à determinada temperatura.
Considerando-se essas informações, é correto afirmar:
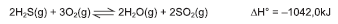
O deslocamento do equilíbrio químico de um sistema é toda e qualquer alteração de velocidade de reação direta ou inversa, que provoca modificações nas concentrações de substâncias químicas e, consequentemente, leva a um novo estado de equilíbrio.
A aplicação desse conceito de deslocamento de equilíbrio químico ao sistema representado pela equação química permite corretamente afirmar:
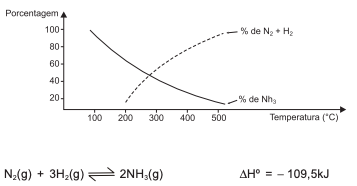
O gráfico mostra a variação do rendimento de amônia com a variação da temperatura de acordo com o sistema em equilíbrio químico, a 100,0atm, representado pela equação termoquímica.
Uma análise desse gráfico e do sistema em equilíbrio químico
representado pela equação termoquímica permite afirmar:
A partir da compreensão dessa informação, é correto afirmar:
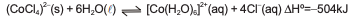
As pequenas esferas azuis de sílica gel utilizadas como desumidificadores no transporte e na proteção de aparelhos eletroeletrônicos, em atmosfera úmida, absorve água do ambiente tornando-se cor de rosa. Ao serem aquecidas em uma estufa, voltam a ter a cor azul inicial de acordo com o sistema em equilíbrio químico representado pela equação química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:
 NH4OH(aq)
NH4OH(aq)  NH+4 (aq) + OH− (aq)
NH+4 (aq) + OH− (aq)
 NH4OH(aq)
NH4OH(aq)  NH+4 (aq) + OH− (aq)
NH+4 (aq) + OH− (aq)
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
