Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 634 questões
O incêndio na boate Kiss, em Santa Maria (RS), ocorrido no início deste ano [2013], trouxe à tona uma série de questões sobre a segurança dos estabelecimentos e também sobre o atendimento a vítimas de grandes incêndios. Uma delas é por que foi preciso trazer dos Estados Unidos uma substância tão simples – uma vitamina B injetável – para atender os pacientes que, segundo exames, foram intoxicados com cianeto?

O gás cianídrico liberado na queima da espuma, utilizada para melhorar a acústica da casa noturna, intoxicou a maior parte das vítimas, segundo perícia.
“É descaso e ignorância”, resume o toxicologista Anthony Wong, diretor do Ceatox (Centro de Assistência Toxicológica do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo). Segundo ele, é inadmissível que o país não tenha a substância e que seu uso não seja difundido entre médicos e socorristas, como acontece em outras partes do mundo.
A hidroxocobalamina, que faz parte do complexo B, é usada em altas concentrações como antídoto para o cianeto. O gás, o mesmo que já foi usado no extermínio de judeus nos campos de concentração nazistas, é subproduto da queima de diversos componentes usados na indústria, como o plástico, o acrílico e a espuma de poliuretano. Segundo os peritos que investigam o incêndio em Santa Maria, essa última foi usada no isolamento acústico da boate.
Capaz de matar em poucos minutos, o cianeto bloqueia a cadeia respiratória das células, impedindo que o oxigênio chegue aos órgãos e tecidos. Quando usada logo após a exposição, a hidroxocobalamina salva vidas. “O efeito é tão rápido que parece até milagroso”, conta Wong. Mas isso não é algo que os médicos aprendem na escola: “São poucas as faculdades que oferecem curso de toxicologia e, nas que tem, a matéria é opcional”.
(noticias.uol.com.br. Adaptado.)
Informações adicionais:
• O gás cianídrico é o cianeto de hidrogênio (HCN) no estado gasoso.
• A fórmula estrutural da hidroxocobalamina é:

• A massa molar da hidroxocobalamina é aproximadamente igual
a 1,3 × 10³g/mol.
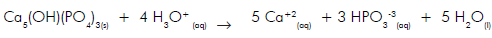
Ao adicionarmos esse fosfato natural em solos ácidos ocorrerá
A altas temperaturas, N2 reage com O2 produzindo NO, um poluente atmosférico:
N2(g) + O2(g) ⇌ 2NO(g)
À temperatura de 2000 kelvins, a constante do equilíbrio acima é igual a 4,0 x 10-4. Nesta temperatura, se as concentrações de equilíbrio de N2 e O2 forem, respectivamente, 4,0 x 10-3 e 1,0x10-3 mol/L, qual será a de NO?
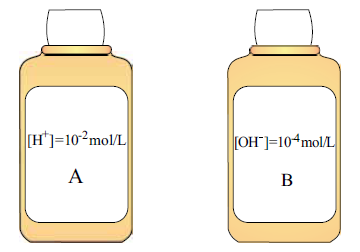
A razão entre os valores de pH da solução B e da solução A, a 25 o C, é

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Considere o equilíbrio químico: A 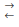 2B + C e as concentrações iniciais seguintes:
2B + C e as concentrações iniciais seguintes:
Um experimento, realizado a 25 °C, mostrou que para 1 litro de reagente o equilíbrio foi atingido quando 0,5 moles
do reagente foram consumidos. Assinale o valor da constante de equilíbrio da reação.
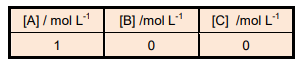
 2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C.
2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C. 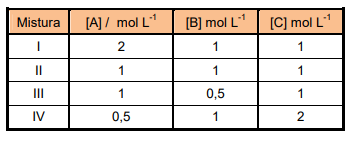
É CORRETO afirmar que está em equilíbrio a mistura:
4NH3 (g) + 5O2 (g)
 4NO (g) + 6H2O (g)
4NO (g) + 6H2O (g)  H < 0
H < 0 Qual das afirmações a seguir é INCORRETA?
Considere o processo de equilíbrio de formação do óxido de carbono:
C(s) + 1/2 O2(g) ⇄ CO(g) ∆H = -110,5 kJ mol-1
É CORRETO afirmar que:
Após o preparo de uma solução 5x10-2 mol/L de NaNO2, pode-se afirmar que o pH é aproximadamente igual a: (Dados: Ka=5x10-4 para HNO2); Kw=1,0x10-14 a 25°C).
I. Ionização II. Mistura heterogênea III. Dissociação iônica
1. Etanol 2. Soda cáustica 3. Óleo de cozinha 4. Ácido clorídrico
A associação correta é:
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A adição de um catalisador na reação II, em equilíbrio, favorece o rendimento em H2
.
