Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
PCl3(g) + Cl2(g) PCl5(g)
Sob essas condições, o efeito causado sobre a referida reação é:
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio

A concentração máxima permitida para fenóis em águas
não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a
concentração máxima permitida para fenóis pela resolução
n° 357 do CONAMA é de 0,003 mg/L.
Os químicos do laboratório de análises de uma indústria de tintas prepararam cinco amostras, cada uma com 1000 mL de efluente do processo, contendo fenol. A quatro delas, adicionaram – a cada uma separadamente – 0,1 mol das seguintes substâncias: KBr, NaCl, NaOH, HCl. A quinta amostra foi mantida apenas com o efluente. Após esse procedimento, fizeram análises da concentração de fenolato, C6 H5 O– , por instrumento de medida, em cada uma das cinco amostras.
Ao final dessa pesquisa, os químicos concluíram corretamente que a amostra que apresentou maior concentração de íon fenolato, dentre as cinco, foi aquela contendo
O nitrito de sódio, NaNO2 , é um conservante de alimentos processados a partir de carnes e peixes. Os dados de solubilidade deste sal em água são apresentados na tabela.

Em um frigorífico, preparou-se uma solução saturada de
NaNO2
em um tanque contendo 0,5 m3
de água a 50°C. Em
seguida, a solução foi resfriada para 20°C e mantida nessa
temperatura. A massa de NaNO2
, em kg, cristalizada após o
resfriamento da solução, é
Considere: Densidade da água = 1 g/mL
A titulação de 50 mL de uma solução aquosa de ácido clorídrico, com uma solução aquosa de hidróxido de sódio de concentração molar igual a 0,1 mol/L, utilizando fenolftaleína como indicador, está representada no gráfico a seguir.
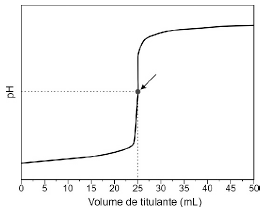
Considerando as informações do enunciado e do gráfico, assinale a alternativa correta.
TEXTO 2
XX
Os Homens
nesta manhã de sangrenta primavera
parecem não mais saber
o que nunca souberam,
que a Vida é para sempre
sã ou demente
tão de repente
tão de repente!
(VIEIRA, Delermando. Os tambores da tempestade. Goiânia: Poligráfica, 2010. p. 108.)
Hb + O2
 HbO2
HbO2Com base nessas informações, analise as afirmativas a seguir:
I- O sangue, por ser uma solução tampão, não sofrerá alteração de pH, mesmo com a adição de grande quantidade de ácidos ou de bases.
II- O sangue tem pH em torno de 7, e o suco gástrico,em torno de 2. Isso significa uma diferença de concentração de íons hidrônio na ordem de 105.
III- Ao se subir a montanha Everest, a mudança na pressão atmosférica resulta no deslocamento da reação da hemoglobina com o oxigênio para a esquerda.
IV-O CO2 proveniente da respiração celular pode reagir com a água antes de ser transportado pela hemoglobina e ser transformado em íons hidrônio e carbonato (CO32–). A geometria molecular desse ânion é piramidal.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq)  H+ (aq) + CN–
(aq)
H+ (aq) + CN–
(aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
Dados: Ka (CH3COOH) = 1,8 x 10-5 (250C), log 2 = 0,30 e log 3 = 0,47.
NH3 (g) + H2O ( l) ⇌ NH4 + (aq) + OH− (aq)
A liberação de gás amônia ocorrerá com maior intensidade quando a essa solução for adicionado
I. NH4Cl (aq).
II. FeCl3 (aq).
III. NaOH (aq).
Está correto o que consta APENAS em
O mineral calcita, CaCO3, é um dos principais constituintes do mármore. Esse mineral pode ser dissolvido com ácidos, porque ocorre a seguinte reação:
CaCO3 (s) + 2H+ (aq) → Ca2+ (aq) + CO2 (g) + H2O (l)
Considerando uma solução de ácido clorídrico cujo pH = 0, o volume dessa solução, em mL, necessário para dissolver 1,0 g de CaCO3 é deMassa molar do CaCO3 = 100 g.mol−1
Durante o verão, verificam-se habitualmente tempestades em muitas regiões do Brasil. São chuvas intensas e de curta duração, acompanhadas muitas vezes de raios. No litoral, essas tempestades constituem um risco para os banhistas, pois a água salgada é eletricamente condutora. Isso se explica pelo fato de a água salgada conter grande quantidade de _________, como Na+ e Cl−, livres para transportar carga elétrica no meio. Uma maneira de liberar essas partículas é dissolver sal de cozinha em um copo de água. Nesse processo, os _________ existentes no sal sofrem _________.
As expressões que completam corretamente o texto são, respectivamente:
I. A concentração de cátions H+ é 1000 vezes maior na solução de pH 9 em relação à solução de pH 12.
II. A concentração de ânions OH- na solução de pH 9 é 75% da concentração desse mesmo ânion na solução de pH 12.
III. Os gases borbulhados podem ser CH4 ou NH3 .
IV. Os gases borbulhados podem ser CO2 ou SO2 .
Estão corretas apenas as afirmações
Considere o sistema em equilíbrio a 25°C e 1 atm que representa a queima ou combustão do metanol líquido:
2CH3OH (l) + 3 O2 (g) ⇄ 2CO2(g) + 4H2O(l) H = -1452 kJ
Assinale a alternativa VERDADEIRA:
Dado: log 2 = 0,3
É correto afirmar que a diferença de unidades de valores de pH dessas soluções é igual a
Considere a tabela para responder à questão

O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
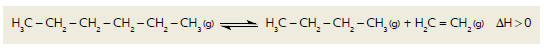
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob
temperatura T1
e pressão P1
. Após seis horas, a temperatura foi elevada para T2 , mantendo-se a
pressão em P1
. Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi
mantida em T2
.
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em:
O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
H3C − CH2 − CH2 − CH2 − CH2 − CH3 (g) ⇌ H3C − CH2 − CH2 − CH3(g) + H2C = CH2 (g) ∆H >0
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob temperatura T1 e pressão P1 . Após seis horas, a temperatura foi elevada para T2 , mantendo-se a pressão em P1 . Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi mantida em T2 .
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
1. Colocou-se um punhado de feijão preto dentro de um béquer com água quente; após algum tempo, observou-se o processo de extração do pigmento do feijão, ficando o líquido de cor lilás.
2. O líquido lilás extraído do feijão preto foi separado e despejado em outro béquer.
3. Acrescentou-se a esse líquido lilás um grânulo de soda cáustica; em seguida, observou-se que a cor da solução se alterou para um tom verde escuro.
4. Foi adaptada, na boca do béquer, uma luva cirúrgica contendo um comprimido efervescente cuja composição química continha bicarbonato de sódio e ácido acetilsalicílico, tomando-se o devido cuidado para o comprimido não entrar em contato com o líquido.
5. Em seguida, a luva foi virada para o lado oposto, possibilitando ao comprimido efervescente reagir com a solução básica do líquido do feijão preto. Observando-se a ação dos produtos na luva cirúrgica e na solução resultante, constatou-se que a luva inflou e a solução mudou de cor para um tom rosado.
Com relação a essa experiência, assinale a afirmação correta.