Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Considerando que no equilíbrio a 60 °C, a pressão parcial do tetróxido de dinitrogênio é 1,4 atm e a pressão parcial do dióxido de nitrogênio é 1,8 atm, a constante de equilíbrio Kp será, em termos aproximados,
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
N2(g) + 3H2(g) ⇄ 2NH3(g)
Em determinada condição de temperatura e depois de se atingir o equilíbrio, as pressões parciais de nitrogênio, hidrogênio e amônia se estabilizaram em 0,5, 1,5 e 2,0 atm, respectivamente. O valor da constante de equilíbrio Kp para esse sistema, expresso em atm-2 , é:
Sabe-se que, para esse equilíbrio, a constante Kp vale:
Kp = 1,5 x 10-3 atm-2 a 200 ºC Kp = 3,0 x 10-2 atm-2 a 300 ºC
Marque a resposta correta:
A(g) + 2B(g) ⇄ 3C(g) + 4D(l)
Na indústria têxtil, é uma prática comum aplicar goma aos tecidos no início da produção, para torná-los mais resistentes. Esse produto, entretanto, precisa ser removido posteriormente, no processo de desengomagem. Nesse processo, os produtos têxteis são mergulhados em um banho aquoso com uma enzima do grupo das amilases.
Os gráficos nas figuras 1 e 2 representam a eficiência da atividade dessa enzima em diferentes valores de temperatura e pH.
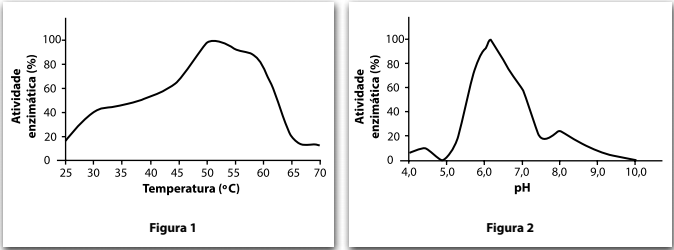
Com base nas informações apresentadas, está correto afirmar que, para se obter a máxima eficiência da ação da enzima no
processo industrial citado no texto, seria necessário manter o banho aquoso de desengomagem a
Assinale a resposta que apresenta a pureza da amostra analisada.
2SO3(g)
 2SO2(g) + O2(g)
2SO2(g) + O2(g)Assinale a alternativa que apresenta, para a reação dada, a expressão da constante de equilíbrio em termos de pressão parcial:
Estudos ambientais revelaram que o ferro é um dos metais presentes em maior quantidade na atmosfera, apresentando- -se na forma do íon de ferro 3+ hidratado, [Fe(H2 O)6 ] 3+. O íon de ferro na atmosfera se hidrolisa de acordo com a equação
[Fe(H2 O)6 ] 3+ ↔ [Fe(H2 O)5 OH]2+ + H+
(Química Nova, vol. 25, n.º 2, 2002. Adaptado) Um experimento em laboratório envolvendo a hidrólise de íons de ferro em condições atmosféricas foi realizado em um reator de capacidade de 1,0 L. Foi adicionado inicialmente 1,0 mol de [Fe(H2 O6 ) ]3+ e, após a reação atingir o equilíbrio, havia sido formado 0,05 mol de íons H+. A constante de equilíbrio dessa reação nas condições do experimento tem valor aproximado igual aConsidere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
I. KCl(aq) + AgNO3(aq) → AgCl(s) + KNO3(aq)
II. FeCl3(aq) + SnCl2(aq) → FeCl2(aq) + SnCl4(aq)
III. Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + H2O(l)
Nessas equações, os símbolos (aq), (s) e (l) representam, respectivamente, “espécies químicas dissolvidas em água", “espécies químicas no estado sólido" e “espécies químicas no estado líquido".
É correto afirmar que, na reação indicada, são íons espectadores
O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
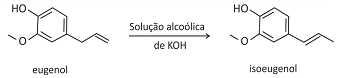
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
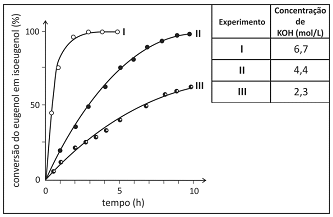
Analisando-se o gráfico, pode-se concluir corretamente que
O processo de dissolução do sulfato de sódio em água é exotérmico, conforme a equação:
Na2SO4
(s)  2 Na+(aq) + SO42–(aq) + calor.
2 Na+(aq) + SO42–(aq) + calor.
À medida que se resfria o sistema, é possível observar um deslocamento do equilíbrio em um certo sentido.
Pode-se promover deslocamento no mesmo sentido com
O nitrato de potássio possui o seguinte gráfico de solubilidade (g/100 g de água) em função da temperatura:
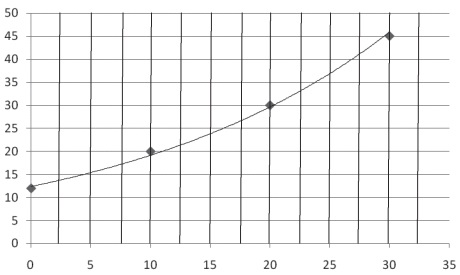
Considere uma solução saturada de KNO3 que contem, alem do sal, 500 g de H2O e está a 20ºC. Essa solução é resfriada sob agitação constante a 10ºC. Da analise da curva de solubilidade, podemos concluir que
N2(g) + H2(g)
 NH3(g)
NH3(g)Em uma mistura dos três gases, a 480 °C, a constante de equilíbrio é, aproximadamente, igual a 1,5 x 10-5 . Supondo-se que as pressões parciais de N2 e de H2 sejam iguais a 0,6 e 1,0 atm, respectivamente, a pressão parcial de NH3 nessa mistura em equilíbrio, em atm, é igual a
Tubo A: 10 mL de solução de hidróxido de cálcio
Tubo B: 10 mL de solução diluída de hidróxido de amônio com gotas de fenolftaleína a 0,1%
Tubo C: 10 mL de água
Pela adição de porções de gelo seco aos tubos, ocorre
