Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 636 questões
Sob temperatura constante, acrescentou-se cloreto de sódio em água até sobrar sal sem se dissolver, como corpo de fundo. Estabeleceu-se assim o seguinte equilíbrio:
NaCℓ (s) ⇌ Na+ (aq) + Cℓ – (aq)
Mantendo a temperatura constante, foi acrescentada mais uma porção de NaCℓ (s). Com isso, observa-se que a condutibilidade elétrica da solução sobrenadante ________ , a quantidade de corpo de fundo _______________ e a concentração de íons em solução ________ .
As lacunas do texto devem ser preenchidas, respectivamente, por:
A mandioca, uma das principais fontes de carboidratos da alimentação brasileira, possui algumas variedades conhecidas popularmente como “mandioca brava”, devido a sua toxicidade. Essa toxicidade se deve à grande quantidade de cianeto de hidrogênio (HCN) liberado quando o tecido vegetal é rompido.
Após cada etapa do processamento para a produção de farinha de mandioca seca, representado pelo esquema a seguir, quantificouse o total de HCN nas amostras, conforme mostrado no gráfico que acompanha o esquema.
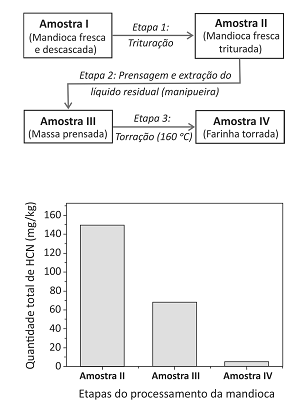
O que ocorre com o HCN nas Etapas 2 e 3?
Considere a tabela, que apresenta indicadores ácido-base e seus respectivos intervalos de pH de viragem de cor.

Para distinguir uma solução aquosa 0,0001 mol/L de HNO3
(ácido forte) de outra solução aquosa do mesmo ácido
0,1 mol/L, usando somente um desses indicadores, deve-se
escolher o indicador
Dado: MM (KOH) = 56 g.mol-1
De acordo com as informações apresentadas, verifica-se que essa solução apresenta
SOLUÇÃO-TAMPÃO: DEFINIÇÃO CONTEMPORÂNEA
Hoje, o conceito de tampão é aplicado nas diversas áreas do conhecimento. Bioquímicos utilizam tampões devido ao fato de as propriedades de qualquer sistema biológico ser dependente do pH; além disso, em química analítica e industrial, o controle adequado do pH pode ser essencial na determinação das extensões de reações de precipitação e de eletrodeposição de metais, na efetividade de separações químicas, nas sínteses químicas em geral e no controle de mecanismos de oxidação e reações eletródicas. Uma definição mais abrangente foi apresentada, recentemente, por Harris (1999): uma solução tamponada resiste a mudanças de pH quando ácidos ou bases são adicionados ou quando uma diluição ocorre. Embora haja outros tipos de solução-tampão, essas soluções são constituídas geralmente de uma mistura de um ácido fraco e sua base conjugada (exemplo: ácido acético e acetato de sódio) ou da mistura de uma base fraca e seu ácido conjugado (exemplo: amônia e cloreto de amônio).
Disponível em:<http://qnesc.sbq.org.br/online/qnesc13/v13a04.pdf> . Acesso em: 07 de agosto de 2016.
Em um laboratório de Química, uma solução-tampão foi preparada pela mistura de 250 mL de uma solução aquosa de ácido etanoico (H3CCOOH) 0,20 mol/L com 250 mL de solução aquosa de hidróxido de sódio (NaOH) 0,10 mol/L.
Qual o pH da solução obtida?
Dado: pKa do ácido etanoico = 4,75; log 2 = 0,3
A ÁGUA
A água é o melhor solvente que existe. O pH é determinado por meio de uma escala universal graduada de 0 a 14, a 25 °C, sendo 7 o ponto correspondente à neutralidade. Portanto, quando a água tem um pH inferior a 7, diz-se que a água é ácida; se é igual a 7, diz-se que é neutra e, se é superior a 7, diz-se que a água é alcalina. É importante saber que, em condições de saúde, o líquido intracelular e o extracelular apresentam um pH que oscila entre 7,35 e 7,45, ou seja, levemente alcalino. Nosso organismo tende à alcalinidade, então a água saudável deve ser alcalina.
Disponível em:<http://phsaude.blogspot.com.br/2014/07/o-que-e-ph.html> . Acesso em: 7 de agosto de 2016.
Qual das substâncias a seguir se deve adicionar à água que será consumida por um indivíduo, para torná-la saudável?
As cavernas são formadas pela dissolução de carbonato de cálcio (CaCO3) em água. Esse sal é muito comum na natureza e pode ser encontrado em grande quantidade na constituição do calcário. Ele não é muito solúvel em água; no entanto, quando está na presença de dióxido de carbono (gás carbônico – CO2) e sendo submetido a altas pressões, o carbonato de cálcio se solubiliza bem na água. As águas subterrâneas se encontram exatamente nessas condições, isto é, com grande quantidade de gás carbônico dissolvido e a elevadas pressões. Assim, quando as águas subterrâneas passam por terrenos contendo calcário, ocorre a dissolução do carbonato de cálcio, conforme pode ser representado pela seguinte equação química:
CaCO3(s) + CO2(g) + H2O(ℓ) → Ca2+(aq) + 2HCO-3(aq) ΔH < 0
Entretanto, essa reação também pode ocorrer no sentido inverso, resultando na formação do calcário. Isso acontece, por exemplo, quando essas águas ficam no teto das cavernas e vão gotejando muito lentamente. Dessa forma, a água vai evaporando e também há a liberação do CO2(g), e o carbonato vai se depositando na forma de estalactites no teto e estalagmites no chão das cavernas.
Ca2+(aq) + 2 HCO-3(aq) → CaCO3(s) + CO2(g) + H2O(ℓ) ΔH > 0
Disponível em:<http://mundoeducacao.bol.uol.com.br/quimica/formacaoconstituicao-estalactites-estalagmites.htm> . Acesso em: 29 de julho de 2016.
2HI(g) ⇌ H2(g) + I2(g) ΔH° = − 53kJ
Uma análise dessas informações permite afirmar:
Em um recipiente aberto, a água evapora até o fim, na temperatura e pressão ambiente. Entretanto, quando o recipiente é fechado, as moléculas de água são impedidas de escapar, ocorrendo, então, um equilíbrio de evaporação entre água líquida e vapor, a 25o°C e 1,0atm. Uma análise dessas informações permite corretamente concluir:
A hemoglobina (Hb) é a proteína responsável pelo transporte de oxigênio. Nesse processo, a hemoglobina se transforma em oxihemoglobina (Hb(O2)n). Nos fetos, há um tipo de hemoglobina diferente da do adulto, chamada de hemoglobina fetal. O transporte de oxigênio pode ser representado pelo seguinte equilíbrio:
Hb + nO2 ⇌ Hb(O2)n ,
em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal. A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
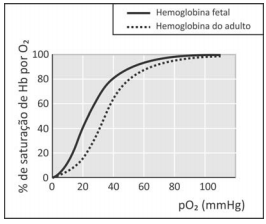
A porcentagem de saturação pode ser entendida como:
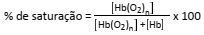
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
É correto apenas o que o estudante afirmou em
Note e adote:
pO2 (pulmão) > pO2 (tecidos).
[PCl5] = 1,5 mol/L, [Cl2] = 0,3 mol/L
A concentração molar de PCl3 no equilíbrio é :
I. Soluções ácidas são aquelas que têm pH < 6,5. II. Soluções neutras têm pH = 6,5 III. Soluções básicas têm pH > 6,5. IV. pH+pOH tem que ser igual a 13,0. V. Solução com pH = 14 é impossível de ser obtida.
Das afirmações anteriores estão CORRETAS:
I. Soluções ácidas são aquelas que têm pH < 6,5. II. Soluções neutras têm pH = 6,5 III. Soluções básicas têm pH > 6,5. IV. pH+pOH tem que ser igual a 13,0. V. Solução com pH = 14 é impossível de ser obtida.
Das afirmações anteriores estão CORRETAS: