Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 630 questões
 NH4OH(aq)
NH4OH(aq)  NH+4 (aq) + OH− (aq)
NH+4 (aq) + OH− (aq)
 NH4OH(aq)
NH4OH(aq)  NH+4 (aq) + OH− (aq)
NH+4 (aq) + OH− (aq)
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

A aplicação do princípio de Le Chatelier possibilita o controle da direção e da extensão de uma determinada reação química. Um exemplo típico é o equilíbrio entre as formas cor de rosa e azul dos íons cobalto em solução aquosa, como representado a seguir.
 [CoCl4]
+2
(aq) + 6 H2O(l)
[CoCl4]
+2
(aq) + 6 H2O(l)
Sobre isso, assinale o que for correto.
A2(g) + B2(g)
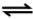 2 AB(g)
2 AB(g)
Considerando-se que, no estado de equilíbrio químico, a concentração da espécie AB(g) seja de 0,1 mol·L-1, a constante de equilíbrio (KC), para esse processo, é aproximadamente igual a
Dado: log 2 = 0,3
Sendo assim, para produzir a toxina botulínica, em um meio de cultivo dessas bactérias, a concentração de íons H+ deve estar entre
BaSO4 (s) → Ba2+(aq) + SO4 2- (aq) K2SO4 (s) → 2K+ (aq) + SO4 2- (aq)
A função do sulfato de potássio nessa situação é:
H2(g) + S(s)
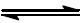 H2S(g)
H2S(g)
as quantidades de gás hidrogênio e sulfeto de hidrogênio são 0,40 g e 0,47 g, respectivamente, determine a constante de equilíbrio, Kc para a reação em estudo.
Dados: Massas molares em g . mol−1 : H = 1; S = 32.
2 CrO42-(aq) + H+(aq)
 Cr2O72-(aq) + H2O(l)
Cr2O72-(aq) + H2O(l)
À partir deste equilíbrio, foram feitas três afirmações:
1) Em pH ácido, o equilíbrio será deslocado para a formação do íon dicromato.
2) Em pH básico, o equilíbrio será deslocado para a formação de íon cromato.
3) O equilíbrio químico não é dinâmico, por isso acima de pH 7 deve ocorrer o consumo total de íons dicromato.
Está(ão) correta(s) a(s) afirmativa(s):
CO2(aq) + H2O(l) ⇌ H2CO3(aq) ⇌ H 1+ (aq) + HCO3- (aq)
Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o HCO3- (aq) e o H2CO3(aq) é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao organismo, devido às alterações metabólicas, podendo causar a morte.
Levando em conta as informações acima, é correto afirmar que
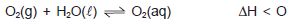
A dissolução de oxigênio do ar atmosférico na água é de fundamental importância para manutenção de seres vivos nos oceanos, rios e lagos. Assim, algumas espécies de peixes, por necessitarem de taxas relativamente elevadas de oxigênio dissolvido, O2(aq), são, para a sobrevivência, atendidas. O processo de dissolução pode ser representado pelo sistema em equilíbrio químico no destaque.
Com base nas informações do texto e do sistema em equilíbrio químico, marque com V as proposições verdadeiras e com F, as falsas.
( ) As concentrações de oxigênio dissolvido, à baixa temperatura nas águas dos lagos, nos Andes, é maior do que nas lagoas
e nos rios, no litoral do Nordeste.
( ) As chances de sobrevivência de peixes de águas frias, em altitudes elevadas, é bem maior que na lagoa Rodrigo de Freitas,
no Rio de Janeiro.
( ) A solubilidade de oxigênio na água salgada é muito maior do que nos rios e lagos ao nível do mar.
A alternativa que contém a sequência correta, de cima para baixo, é a
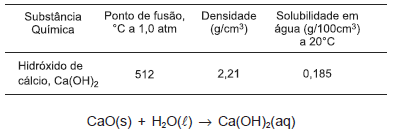
O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante.
Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
Ca10(PO4)6(OH)2 (s) + H+ → 10 Ca+2 (aq.) + 6 HPO4 -2 (aq.) + 2 H2O (l)
Em relação à reação de degradação da hidroxiapatita, são todas substâncias que impedem a solubilização do esmalte dentário:
Tendo por base esta informação, assinale a afirmação verdadeira.
