Questões de Vestibular de Química - Equilíbrio Químico
Foram encontradas 630 questões
Cada tipo de planta cresce melhor em solos com faixa específica de pH. Os valores de pH do solo se devem à solução intersticial presente, ou seja, a água presente no solo e seus respectivos solutos. A tabela abaixo fornece a faixa de “pH ótimo” para algumas plantas, o que facilita a produtividade de flores e frutos.
CaO(s) + H2O(l)
 Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq) + 2 OH-
(aq)
Ca2+(aq) + 2 OH-
(aq) 
Cada tipo de planta cresce melhor em solos com faixa específica de pH. Os valores de pH do solo se devem à solução intersticial presente, ou seja, a água presente no solo e seus respectivos solutos. A tabela abaixo fornece a faixa de “pH ótimo” para algumas plantas, o que facilita a produtividade de flores e frutos.

Cada tipo de planta cresce melhor em solos com faixa específica de pH. Os valores de pH do solo se devem à solução intersticial presente, ou seja, a água presente no solo e seus respectivos solutos. A tabela abaixo fornece a faixa de “pH ótimo” para algumas plantas, o que facilita a produtividade de flores e frutos.
Dada a reação: X2+3Y2 ⇌ 2XYƒ, verificou-se no equilíbrio, a 1000°C, que as concentrações em moles/ litro são: [X2] = 0,20, [Y3] = 0,20, [XY3] = 0,60
O valor da constante de equilíbrio da reação química é de:
A decomposição do peróxido de hidrogênio pode ser representada pela equação:
H2O2(l) → H2O(l) + 1/2O2 (g) ΔH < 0
Das seguintes condições:
I. 25°C e ausência de luz
II. 25°C e presença de catalisador
III. 25°C e presença de luz
IV. 35°C e ausência de luz
V. 35°C e presença de catalisador
Aquela que favorece a CONSERVAÇÃO do peróxido de hidrogênio é:
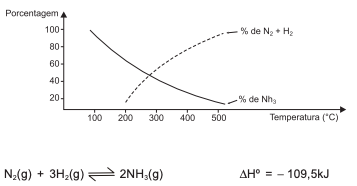
O gráfico mostra a variação do rendimento de amônia com a variação da temperatura de acordo com o sistema em equilíbrio químico, a 100,0atm, representado pela equação termoquímica.
Uma análise desse gráfico e do sistema em equilíbrio químico
representado pela equação termoquímica permite afirmar:
A partir da compreensão dessa informação, é correto afirmar:
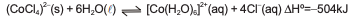
As pequenas esferas azuis de sílica gel utilizadas como desumidificadores no transporte e na proteção de aparelhos eletroeletrônicos, em atmosfera úmida, absorve água do ambiente tornando-se cor de rosa. Ao serem aquecidas em uma estufa, voltam a ter a cor azul inicial de acordo com o sistema em equilíbrio químico representado pela equação química.
A análise desse sistema em equilíbrio químico e das
informações referidas no texto permite afirmar:
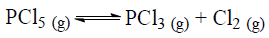
As concentrações de PCl3 e Cl2 são 0,01 mol/L e 0,30 mol/L, respectivamente. Sabendo que Kc = 0,006 na mesma temperatura, calcule a concentração de PCl 5 nesse equilíbrio.
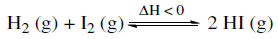
De acordo com o princípio de Le Chatelier, indique a alternativa que aponta uma maneira de o equilíbrio acima ser deslocado no sentido de produzir uma maior quantidade do produto.

analise as afirmativas a seguir:
1) O ácido carbônico é um ácido forte. 2) Em pH 7,0, a razão entre as concentrações do íon bicarbonato e do ácido carbônico ([HCO3 − ]/[H2CO3]) é igual a 4,3. 3) No equilíbrio representado pela equação acima, o íon hidrogenocarbonato é uma base de BronstedLowry
Está(ão) correta(s) apenas:
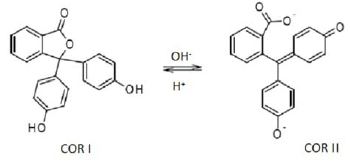
Sobre esses dados é correto afirmar que
A partir de um sistema inicialmente em equilíbrio e segundo o princípio de Le Chatelier é correto afirmar que
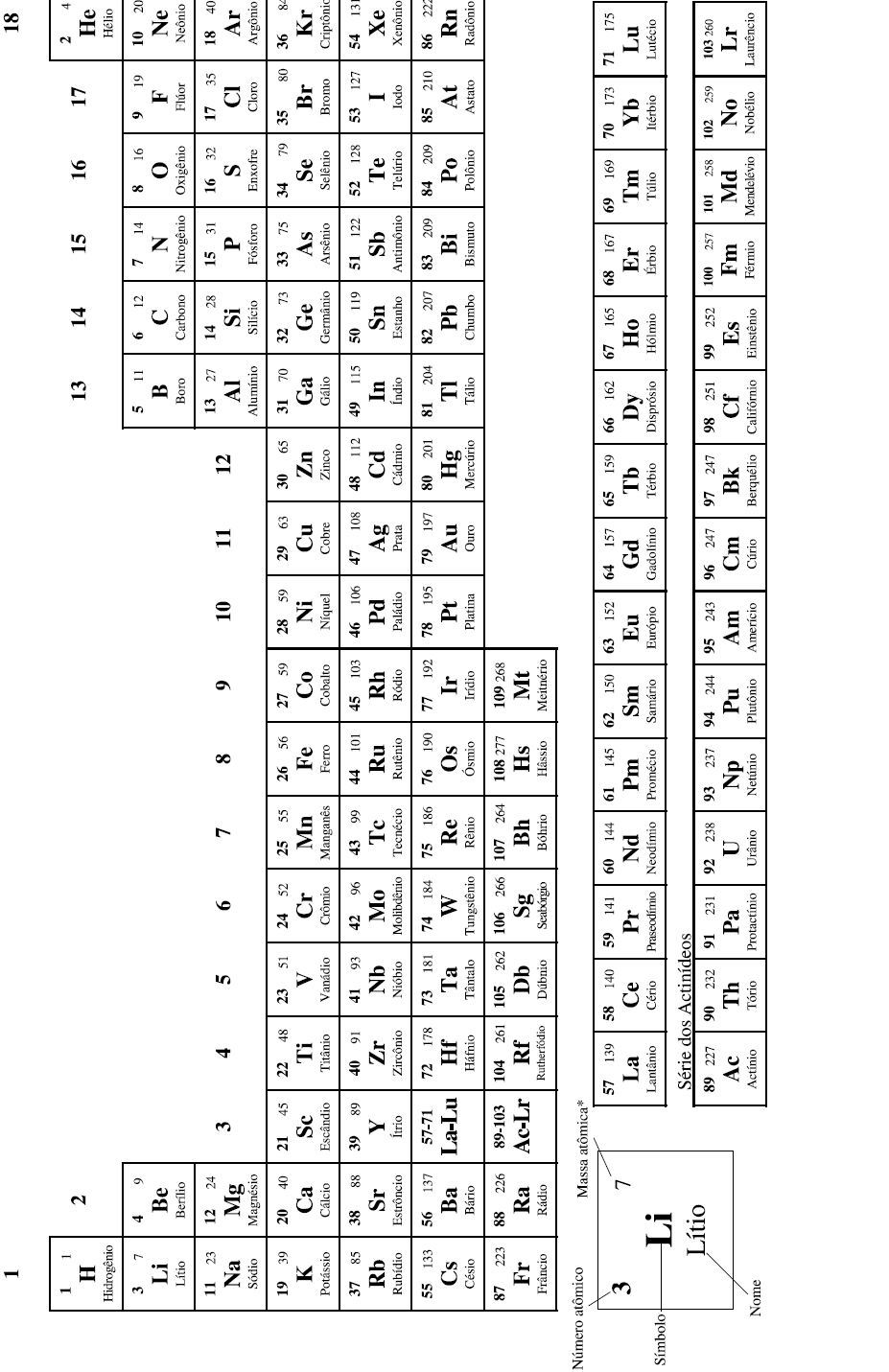
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
CO (g) + Cl2(g)
 COCl2(g)
COCl2(g)Com base nos dados do enunciado, um aumento na temperatura acima de 100 °C (à pressão constante) deverá favorecer a produção de COCl2(g).
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
CO (g) + Cl2(g)
 COCl2(g)
COCl2(g)A 100 °C, o equilíbrio encontra-se deslocado para a esquerda e, portanto, predominam os reagentes.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
CO (g) + Cl2(g)
 COCl2(g)
COCl2(g)No equilíbrio a 25 °C, se a pressão de CO(g) e Cl2(g) forem iguais a 10 atm, a pressão do COCl2(g) será igual a 1 atm.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
CO (g) + Cl2(g)
 COCl2(g)
COCl2(g)A 10 °C, o equilíbrio encontra-se deslocado para a direita e, portanto, predominam os produtos.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
CO (g) + Cl2(g)
 COCl2(g)
COCl2(g)A expressão da constante de equilíbrio para essa reação pode ser escrita como Keq = Kp = (PCOCL2) (PCL2) / PCO