Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 634 questões
Observe a escala abaixo:

O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com a escala acima, que relaciona a cor final do sistema substância + indicador com o pH aproximado que ela possui. Ao testar algumas soluções com o suco de repolho roxo, foram obtidos os seguintes resultados:
- Amoníaco: verde
- Leite de magnésia: azul
- Vinagre: vermelho
- Leite de vaca: rosa
Com base nessas informações, as substâncias amoníaco, leite de magnésia, vinagre e
leite de vaca têm caráter respectivamente:
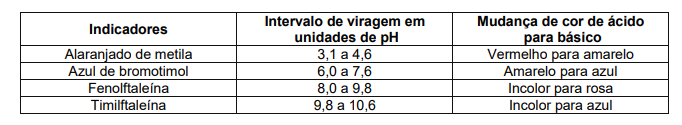
Para diferenciar-se uma solução de pH=5,0 de uma solução de pH=8,0, ambas incolores, deve-se usar o indicador
Com base na expressão
NH4+(aq) ⇄ H+(aq) + NH3(aq)
que representa a solução aquosa do (NH4)Cℓ , é correto afirmar que:
H2 (g) + Cl 2 (g) ⇄ 2 HCl (g) KC = 1,0 x 1017. H2 (g) + Br2 (g) ⇄ 2 HBr (g) KC = 1,0 x 109 . H2 (g) + I2 (g) ⇄ 2 HI (g) KC = 1,0 x 101.
Depois de atingido o equilíbrio,
A formação da casca dos ovos das aves é, geralmente, proveniente da reação:
Ca2+(aq) + CO32-(aq) ⇄ CaCO3(s)
Os íons CO32- são naturalmente produzidos a partir do metabolismo do CO2 e do Ca2+, que são convertidos em H2CO3 enzimaticamente, originando os seguintes equilíbrios:
CO2(g) + H2O(I) ⇄ H2CO3(aq)
H2CO3(aq) ⇄ H+(aq) + HCO3-(aq)
HCO3-(aq) ⇄ H+(aq) + CO32-(aq)
Como as aves não transpiram, faz-se necessária uma intensa respiração para resfriar seus
corpos, acarretando grande liberação de CO2 e, conseqüentemente, a deficiência de íons
CO32-, comprometendo a formação da casca dos ovos. De acordo com o princípio de Le Chatelier, a melhoria do processo de formação da casca dos ovos das aves se dá com
Em condições reacionais adequadas, hidrogênio, H2(g) e cloro, Cℓ 2(g) reagem entre si formando cloreto de hidrogênio, HCℓ (g). Esse processo é reversível e exotérmico, podendo ser representado por
H2(g) + Cℓ 2(g) 2 HCℓ (g) ΔH = - 92,3 kJ . mol –1 .
Depois de atingido o equilíbrio, o fator que não altera esse estado de equilíbrio é a variação da
O estado de equilíbrio existente em um frasco contendo solução de amoníaco, mantido fechado e a temperatura constante, pode ser representado pelas equações:
I - NH3(g) ⇌ NH3 (aq)
II - NH3 (aq) + H2O ⇌ NH4+(aq) + OH-(aq)
III - 2H2O ⇌ H3O+ + OH-
Se o frasco for aberto e assim permanecer por algumas horas, a concentração de
Um estudante de Engenharia Química pipeta 50mL de solução aquosa 0,02mol/L de ácido clorídrico e transfere para um balão volumétrico de 1000mL, ajustando-se para esse volume a solução final, usando água pura.
O pH da solução final é igual a
O gás nitrogênio (N2) reage com o gás oxigênio (O2), conforme a reação a seguir:
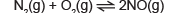
Considere que a constante de equilíbrio da reação é igual a 16 e que as concentrações de equilíbrio de N2 e O2 são, respectivamente, 02mol/L e 02mol/L.
Baseado nos conhecimentos sobre sistemas reversíveis, o valor da concentração molar de NO é igual a
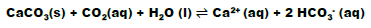
Analise as afirmativas sobre o sistema no equilíbrio e marque a alternativa CORRETA.
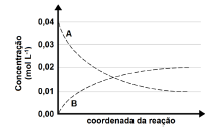
Com base nas informações, analise os itens I a III.
I) A reação balanceada entre as espécies citadas é 3A⇔2B. II) O valor da constante de equilíbrio da reação é 4x102 . III) O equilíbrio estabelecido é deslocado para os produtos ao se diminuir o volume do recipiente.
Está(ão) correto(s):
Os gases hidrogênio e bromo foram colocados para reagir, até o equilíbrio ser atingido, segundo a equação abaixo.
H2(g) + Br2(g) ⇌ 2 HBr(g) ; ΔH° < 0
A tabela a seguir tem duas colunas, uma que indica um tipo de perturbação do equilíbrio e outra que indica a situação final do equilíbrio restabelecido.
Perturbação do equilíbrio
I – aumento da temperatura
II – aumento da pressão pela diminuição do volume do reator
III – adição de catalisador
IV – adição de Br2(g)
Situação final do equilíbrio restabelecido
P – aumento da concentração
de HBr(g)
Q – aumento da concentração de Br2(g)
R – sem alteração signifi cativa das concentrações de equilíbrio
A associação CORRETA de perturbação e situação final do equilíbrio restabelecido é indicada na alternativa
A solubilidade, a 25 o C, do hidróxido de estrôncio é de 4,0 g por 1 L de água.
A partir dessa informação, o produto de solubilidade do Sr(OH)2 é
Dado
M Sr(OH)2
= 122 g mol-1
A solução A foi preparada pela diluição de 100,0 mL de solução de HCl (1,0 mol L-1 ), com água destilada, até completar 1,0 L. Já a solução B foi preparada com 1,0 mL da solução A e misturada com 90,0 mL de solução de NaOH (0,0010 mol L-1 ), para, em seguida, ser diluída para 1,0 L com água destilada.
Na temperatura de 25 °C, em quantas unidades de pH a solução A é MENOR do que a solução B?
Estão corretas as afirmativas
BaSO4 (s) → Ba2+(aq) + SO4 2- (aq) K2SO4 (s) → 2K+ (aq) + SO4 2- (aq)
A função do sulfato de potássio nessa situação é:
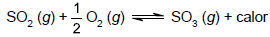
Nesse equilíbrio químico,
