Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 633 questões
A formação da casca dos ovos das aves é, geralmente, proveniente da reação:
Ca2+(aq) + CO32-(aq) ⇄ CaCO3(s)
Os íons CO32- são naturalmente produzidos a partir do metabolismo do CO2 e do Ca2+, que são convertidos em H2CO3 enzimaticamente, originando os seguintes equilíbrios:
CO2(g) + H2O(I) ⇄ H2CO3(aq)
H2CO3(aq) ⇄ H+(aq) + HCO3-(aq)
HCO3-(aq) ⇄ H+(aq) + CO32-(aq)
Como as aves não transpiram, faz-se necessária uma intensa respiração para resfriar seus
corpos, acarretando grande liberação de CO2 e, conseqüentemente, a deficiência de íons
CO32-, comprometendo a formação da casca dos ovos. De acordo com o princípio de Le Chatelier, a melhoria do processo de formação da casca dos ovos das aves se dá com
Em condições reacionais adequadas, hidrogênio, H2(g) e cloro, Cℓ 2(g) reagem entre si formando cloreto de hidrogênio, HCℓ (g). Esse processo é reversível e exotérmico, podendo ser representado por
H2(g) + Cℓ 2(g) 2 HCℓ (g) ΔH = - 92,3 kJ . mol –1 .
Depois de atingido o equilíbrio, o fator que não altera esse estado de equilíbrio é a variação da
O estado de equilíbrio existente em um frasco contendo solução de amoníaco, mantido fechado e a temperatura constante, pode ser representado pelas equações:
I - NH3(g) ⇌ NH3 (aq)
II - NH3 (aq) + H2O ⇌ NH4+(aq) + OH-(aq)
III - 2H2O ⇌ H3O+ + OH-
Se o frasco for aberto e assim permanecer por algumas horas, a concentração de
Um estudante de Engenharia Química pipeta 50mL de solução aquosa 0,02mol/L de ácido clorídrico e transfere para um balão volumétrico de 1000mL, ajustando-se para esse volume a solução final, usando água pura.
O pH da solução final é igual a
O gás nitrogênio (N2) reage com o gás oxigênio (O2), conforme a reação a seguir:
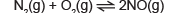
Considere que a constante de equilíbrio da reação é igual a 16 e que as concentrações de equilíbrio de N2 e O2 são, respectivamente, 02mol/L e 02mol/L.
Baseado nos conhecimentos sobre sistemas reversíveis, o valor da concentração molar de NO é igual a
Esse valor de pH é Dado: log 2 = 0,3
SOLUÇÃO-TAMPÃO: DEFINIÇÃO CONTEMPORÂNEA
Hoje, o conceito de tampão é aplicado nas diversas áreas do conhecimento. Bioquímicos utilizam tampões devido ao fato de as propriedades de qualquer sistema biológico ser dependente do pH; além disso, em química analítica e industrial, o controle adequado do pH pode ser essencial na determinação das extensões de reações de precipitação e de eletrodeposição de metais, na efetividade de separações químicas, nas sínteses químicas em geral e no controle de mecanismos de oxidação e reações eletródicas. Uma definição mais abrangente foi apresentada, recentemente, por Harris (1999): uma solução tamponada resiste a mudanças de pH quando ácidos ou bases são adicionados ou quando uma diluição ocorre. Embora haja outros tipos de solução-tampão, essas soluções são constituídas geralmente de uma mistura de um ácido fraco e sua base conjugada (exemplo: ácido acético e acetato de sódio) ou da mistura de uma base fraca e seu ácido conjugado (exemplo: amônia e cloreto de amônio).
Disponível em:<http://qnesc.sbq.org.br/online/qnesc13/v13a04.pdf> . Acesso em: 07 de agosto de 2016.
Em um laboratório de Química, uma solução-tampão foi preparada pela mistura de 250 mL de uma solução aquosa de ácido etanoico (H3CCOOH) 0,20 mol/L com 250 mL de solução aquosa de hidróxido de sódio (NaOH) 0,10 mol/L.
Qual o pH da solução obtida?
Dado: pKa do ácido etanoico = 4,75; log 2 = 0,3
A ÁGUA
A água é o melhor solvente que existe. O pH é determinado por meio de uma escala universal graduada de 0 a 14, a 25 °C, sendo 7 o ponto correspondente à neutralidade. Portanto, quando a água tem um pH inferior a 7, diz-se que a água é ácida; se é igual a 7, diz-se que é neutra e, se é superior a 7, diz-se que a água é alcalina. É importante saber que, em condições de saúde, o líquido intracelular e o extracelular apresentam um pH que oscila entre 7,35 e 7,45, ou seja, levemente alcalino. Nosso organismo tende à alcalinidade, então a água saudável deve ser alcalina.
Disponível em:<http://phsaude.blogspot.com.br/2014/07/o-que-e-ph.html> . Acesso em: 7 de agosto de 2016.
Qual das substâncias a seguir se deve adicionar à água que será consumida por um indivíduo, para torná-la saudável?
As cavernas são formadas pela dissolução de carbonato de cálcio (CaCO3) em água. Esse sal é muito comum na natureza e pode ser encontrado em grande quantidade na constituição do calcário. Ele não é muito solúvel em água; no entanto, quando está na presença de dióxido de carbono (gás carbônico – CO2) e sendo submetido a altas pressões, o carbonato de cálcio se solubiliza bem na água. As águas subterrâneas se encontram exatamente nessas condições, isto é, com grande quantidade de gás carbônico dissolvido e a elevadas pressões. Assim, quando as águas subterrâneas passam por terrenos contendo calcário, ocorre a dissolução do carbonato de cálcio, conforme pode ser representado pela seguinte equação química:
CaCO3(s) + CO2(g) + H2O(ℓ) → Ca2+(aq) + 2HCO-3(aq) ΔH < 0
Entretanto, essa reação também pode ocorrer no sentido inverso, resultando na formação do calcário. Isso acontece, por exemplo, quando essas águas ficam no teto das cavernas e vão gotejando muito lentamente. Dessa forma, a água vai evaporando e também há a liberação do CO2(g), e o carbonato vai se depositando na forma de estalactites no teto e estalagmites no chão das cavernas.
Ca2+(aq) + 2 HCO-3(aq) → CaCO3(s) + CO2(g) + H2O(ℓ) ΔH > 0
Disponível em:<http://mundoeducacao.bol.uol.com.br/quimica/formacaoconstituicao-estalactites-estalagmites.htm> . Acesso em: 29 de julho de 2016.
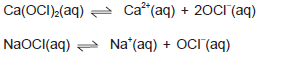
O tratamento de piscinas inclui a cloração da água que pode ser feita com a utilização de Ca(OCl)2(s), NaOCl(aq), e mesmo Cl2(g).Com base nessas informações e nos conhecimentos sobre reações químicas e equilíbrio iônico em soluções aquosas, pode-se afirmar:

Em determinadas cidades, os Centros de Recursos Ambientais orientam para que não sejam lançados no meio ambiente efluentes líquidos com pH inferior a 5 ou superior a 9.A tabela apresenta as concentrações de H3O+(aq) ou OH−(aq)nos efluentes industriais X, Y e Z. Com base nessas informações e nos conhecimentos sobre equilíbrio químico, estudo dos líquidos e química e ambiente, pode-se afirmar, em relação a esses efluentes, que
2HI(g) ⇌ H2(g) + I2(g) ΔH° = − 53kJ
Uma análise dessas informações permite afirmar:
2H2(g) + O2(g)→ 2H2O(v)
Em um recipiente aberto, a água evapora até o fim, na temperatura e pressão ambiente. Entretanto, quando o recipiente é fechado, as moléculas de água são impedidas de escapar, ocorrendo, então, um equilíbrio de evaporação entre água líquida e vapor, a 25o°C e 1,0atm. Uma análise dessas informações permite corretamente concluir:
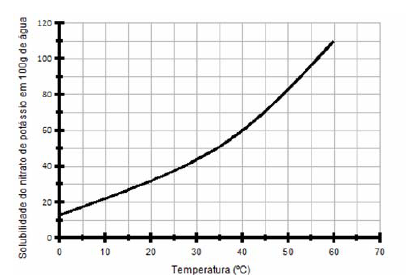
Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)