Questões de Vestibular
Sobre equilíbrio químico em química
Foram encontradas 630 questões
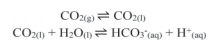
Sabe-se que depois de aberto, o refrigerante vai progressivamente perdendo seu sabor característico. Uma das formas de diminuir a velocidade desse processo é manter a bebida em baixas temperaturas. Essa ação é eficaz porque em baixas temperaturas:
Considere a informação acima e o equilíbrio a seguir:
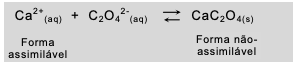
Esse equilíbrio está relacionado com as formas do cálcio assimilável pelo intestino humano e com as do não-assimilável. Uma quantidade elevada de alimentos ricos em oxalato dificulta a absorção de Ca2+ porque
Considere a tirinha a seguir.

FELTRE, Ricardo. Fundamentos da Química, volume único. São Paulo: Moderna, 1996. p.351. [Adaptado]
Aplicada ao equilíbrio químico, a idéia que o personagem tem sobre equilíbrio
I - Colocando-se, em água, uma quantidade de sal superior à sua solubilidade, obtém-se uma solução saturada em equilíbrio com a porção do sal não dissolvida, formando um sistema homogêneo. II - Detecta-se experimentalmente que as concentrações dos íons H3O+ e OH− para as soluções salinas podem ou não ser alteradas em relação às da água pura e que soluções de cloreto de amônio (NH4Cl) são alteradas, com a concentração de H3O+ aumentando e de OH− diminuindo, assim, tem-se que soluções de cloreto de amônio são ácidas. III - Sais que formam soluções básicas têm um ânion capaz de reagir com a água, alterando, para maior, a concentração do íon OH− . IV - A reação de hidrólise de qualquer sal ocorre sempre com a formação de um ácido ou uma base fraca.
Estão corretas as afirmativas
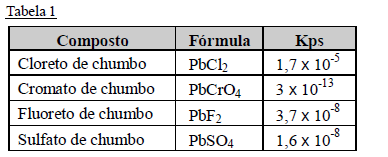
Com base nas informações acima escolha a alternativa que contém a substância mais indicada para a identificação do chumbo II por precipitação em meio aquoso. Considere que todos os sais de metais alcalinos são muito solúveis em água.
Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
I - O índigo, por ser um corante encontrado na natureza, não reage com o tecido e, portanto, permite uma ligação muito mais intensa.
II - Corantes naturais como a brasileína têm a grande vantagem de serem obtidos de fontes naturais renováveis em curto prazo, além de serem mais saudáveis aos seres humanos porque não contêm química.
III - A produção de corantes artificiais tem contribuído para a preservação de espécies vegetais e animais, tendo proporcionado a obtenção de cores bem diversificadas em relação às fontes naturais.
Está(ão) correto(s):
Fritz Haber, prêmio Nobel de química em 1918, ficou famoso por causa da síntese da amônia a partir do nitrogênio atmosférico, alguns meses antes da Primeira Guerra Mundial (1914-1918). A produção inicial, entre três e cinco toneladas de nitrato, aumentou rapidamente com as contribuições de Carl Bosch: em 1918 ultrapassava 300.000 toneladas anuais. O processo Haber-Bosch é uma reação entre o nitrogênio e o hidrogênio para produzir amoníaco. Esta reação é catalisada com ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450°C.
(F): 6H2O + 6CO2 ⇌ C6H12O6 + 6O2
(R): C6H12O6 + 6O2 ⇌ 6H2O + 6CO2
Sabendo-se que a fotossíntese só ocorre em presença de luz, pode-se afirmar que a concentração de
A concentração de CO2 na atmosfera vem aumentando nos últimos anos. Segundo os cientistas, o aumento da quantidade desse gás que é dissolvida no oceano pode prejudicar particularmente os corais e as espécies que têm conchas duras.
O equilíbrio do CO2 em solução aquosa pode ser representado pelas seguintes etapas:
CO2 (g) ⇌ CO2 (aq) (1)
CO2 (aq) + H2O (l) ⇌ H2CO3 (aq) (2)
H2CO3 (aq) ⇌ HCO3 - (aq) + H+ (aq) (3)
A dissolução do CO2 no oceano provoca
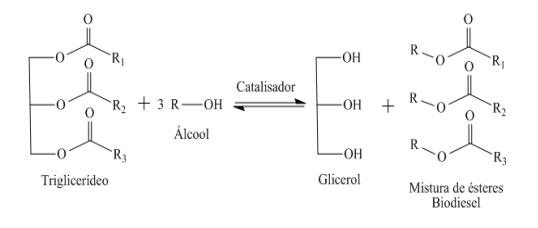
O etanol de segunda geração é obtido a partir de resíduos de biomassa, a exemplo de palhas e bagaço de cana-de-açúcar, sabugo e palha de milho, ricos em celulose, tratados com solução diluída de ácido sulfúrico, H2SO4(aq), (Ka1 > 103 e Ka2 = 1,2.10−2 ), sob aquecimento.
Esse processo produz inicialmente carboidratos menos complexos que a celulose, que, ao serem submetidos à fermentação, produzem etanol. O aproveitamento desses resíduos de biomassa aumenta em quase 100% a produção de etanol de cana-de-açúcar.
Uma análise dessas informações permite afirmar:
HBrO(l) + H2O(l) H+ (aq) + BrO− (aq) Ka = 2,1.10−9 Os trabalhos do químico alemão Friedrich Willhelm Ostwald sobre a relação matemática entre constante de ionização, Ka, com o grau de ionização, α, e com a concentração em mol.L ,m, de um ácido fraco ficaram conhecidos como a Lei de diluição de Ostwald, representada pela expressão
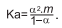 . As suas pesquisas levaram-no ao
recebimento, em 1909, do prêmio Nobel de Química.
. As suas pesquisas levaram-no ao
recebimento, em 1909, do prêmio Nobel de Química.
A partir dessas informações e da reação de ionização do ácido hipobromoso, em uma solução 0,1 molar desse ácido, representada pela equação química, é correto afirmar:
A presença de íons Fe3+(aq) é responsável pelas propriedades características de água ferruginosa de alguns rios.
Uma análise da presença de íons Fe3+(aq) nas águas ferruginosas de alguns rios permite concluir:
 H+(aq) + CN-(aq)
H+(aq) + CN-(aq)
 H+(aq) + CN-(aq)
H+(aq) + CN-(aq)
 H+(aq) + CN-(aq)
H+(aq) + CN-(aq)
 H+(aq) + CN-(aq)
H+(aq) + CN-(aq)