Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 380 questões
A maioria dos aromas que sentimos cotidianamente é consequência da presença de pequenas moléculas orgânicas na composição de produtos do nosso dia a dia. O aroma das rosas, por exemplo, pode ser atribuído aos seguintes compostos como contribuintes principais.

Disponível em: https://www.compoundchem.com/2017/02/14/roses/. Acesso em: 30 jun. 2024 (adaptado).
Com base nas estruturas fornecidas, é correto afirmar que

A partir desses dados, qual a massa, em miligramas, de AAS presente no comprimido?
CH4(g) + 3 Cl2(g) → CHCl3(l) + 3 HCl(g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é
Texto base para a questão.
A Tiquira é um destilado de mandioca muito popular no Maranhão. Alguns consideram a Tiquira a verdadeira aguardente brasileira por ser feita da mandioca, uma planta nativa.
A aguardente tiquira – destilado produzido a partir do mosto fermentado de mandioca, originalmente incolor, adquire uma cor azulada, em razão da adição de folhas ou de flores de tangerina durante o processo de destilação. A obtenção do álcool, no processo de fermentação, ocorre conforme a reação química a seguir:
C6H12O6 → CO2 + CH3CH2OH
glicose etanol
Alguns produtores informais adicionam um corante chamado violeta de metila, conforme estrutura representada a seguir, que garante um vívido azul-arroxeado à bebida. Na Química, essa substância, é utilizada como um indicador para o intervalo de pH com valores de 0 a 1,6, quando apresenta uma coloração amarelada.
Considere os seguintes dados: C = 12 g.mol -1, H = 1 g.mol -1 e O = 16 g.mol -1.
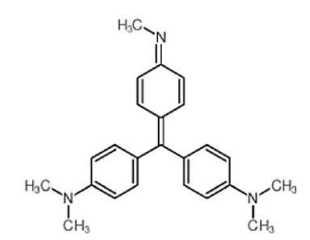
Estrutura química do indicador violeta de metila
A maleabilização é, em princípio, um tratamento térmico ao qual se submetem ferros fundidos com carbono, e que consiste num aquecimento prolongado, em condições previamente estabelecidas de temperatura, de tempo e de meio. O princípio do processo consiste no aquecimento do ferro fundido, em caixas fechadas, num meio oxidante, constituído de minério de ferro. Nessas condições, o carbono do ferro fundido é eliminado sob forma de gás, conforme a reação:
Fe2O3 + 3 CO → 2 Fe + 3 CO2
Benite, A.N.C., da Silva, J.P., Alvino, A.C., Ferro, ferreiro e forja: O ensino de Química pela Lei n° 10.693/03. Educ. Foco, Juiz de Fora, V. 21, n° 03, 2016. Adaptado.
Quanto de ferro maleável, em gramas, pode ser obtido no tratamento de 0,5 Kg do minério de ferro?
Dados de massa atômica (g/mol): Fe = 56; O = 16; C = 12.
S(s) + O2(g) → SO2(g)
Nesse caso, a diferença de massa de SO2 emitido para a atmosfera por kg de diesel quando cada um dos dois tipos é queimado é de
Note e adote: Massas molares (g/mol): O = 16; S = 32. 1 ppm de enxofre equivale a 1 mg de enxofre por kg de diesel.
Considerando as informações do texto apresentado, julgue o item a seguir.
A reação para obtenção do NaClO descrita no texto pode ser balanceada corretamente da seguinte forma.
Cl2 + 2 NaOH → NaCl + NaClO + H2O
Oxigênio (O2) e ozônio (O3) estão em constante processo de consumo e produção na estratosfera, como representado pelas equações químicas a seguir. As reações I e II ilustram etapas da produção de ozônio a partir de oxigênio, e a reação III mostra a restauração de oxigênio a partir de ozônio.
Reação ΔH (kcal/mol de O2)
I O2 → 2 O. −118
II 2 O2 + 2 O. → 2 O3 ΔHII
III 2 O3 → 3 O2 +21

A coagulação é uma das etapas do tratamento de água para consumo humano, na qual são usados compostos químicos que promovem a agregação das partículas de sujeira, formando flocos que se depositam no fundo dos tanques de tratamento. O sulfato de alumínio [Aℓ2(SO4)3] é o agente coagulante mais comum e pode ser usado em conjunto com o aluminato de sódio (NaAℓO2). A reação do processo que emprega o sulfato de alumínio e o aluminato de sódio combinados é representada pela equação não balanceada:
NaAℓO2(s) + Aℓ2(SO4)3 (s) + H2O(ℓ) →
→ Aℓ (OH)3 (s) + Na2SO4 (aq)
Quando se emprega de 1 mol de sulfato de alumínio, os
coeficientes estequiométricos dos produtos hidróxido de alumínio e sulfato de sódio são, respectivamente,
Sabe-se que sua massa molar é 192 g mo1-1 e que a sua composição percentual em massa é de 37,5% de carbono, 58,3% de oxigênio e o restante de hidrogênio. Sua fórmula molecular é, portanto,
Após o balanceamento da equação iônica, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Diariamente, um homem elimina pela urina cerca de 30g de ureia (NH2 )2 ) CO, diariamente conforme a figura apresentada.
Com base nessas informações, o número de átomos de nitrogênio que são eliminados diariamente é igual a
CS2 + H2S + Cu → Cu2S + CH4
Com base nessa informação, julgue o próximo item
Para que a reação apresentada seja balanceada, os coeficientes estequiométricos de seus componentes devem ser iguais a 1, 2, 8, 4 e 1, da esquerda para a direita.
O ácido tereftálico é um diácido carboxílico com fórmula molecular C8H6O4 , muito utilizado na produção de poliéster do tipo PET (polietilenotereftalato).
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Dados
MC = 12 g mol-1
MH = 1 g mol-1
MO = 16 g mol-1
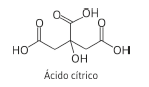
O ácido cítrico pode ser utilizado para a descalcificação de máquinas de café espresso porque reage com o carbonato de cálcio formando

Considere a reação entre sulfeto de sódio e peróxido de hidrogênio que produz sulfato de sódio e água.
A compreensão dessas informações permite concluir que

