Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 377 questões
MnO4- + Fe2+ + H+ → Mn2+ + Fe3+ + H2O
A soma dos coeficientes apenas no lado dos produtos, após o balanceamento, é
2 NaOH(aq) + Cl2(g) → NaClO(aq) + NaCl(aq) + H2O(l)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:
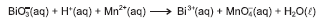
No balanceamento das equações de oxirredução, o fundamental é identificar o número de elétrons recebidos e cedidos, o número total de átomos de cada elemento químico no primeiro e segundo membros da equação química, além do total de carga elétrica em cada um de seus membros. Assim, com base nessas considerações, e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
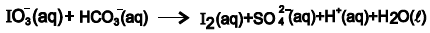
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
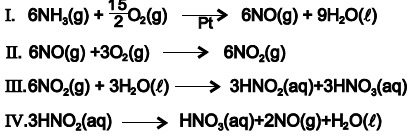
Com base nessas informações e de acordo com as equações químicas que representam o processo de fabricação do ácido nítrico, é correto afirmar:

Assim, considerando-se essas informações e os dados de decomposição de um determinado óxido de nitrogênio, NOx, relacionados na tabela, é correto afirmar:
C6H12O6 + ....... O2 → ....... CO2 + ...... H2O
Uma equação química deve representar a conservação dos átomos, portanto, essa equação estará correta se os coeficientes que estão faltando nas lacunas forem preenchidos, respectivamente, por:

II) A etapa 2 de separação dos gases ocorre por liquefação seguida de destilação fracionada.
III) O processo Haber-Bosch consiste em uma reação de síntese total.
IV)Asoma dos coeficientes mínimos e inteiros da equação na etapa 4 é 19.
V) A etapa 4 é uma reação catalítica de oxirredução.
A sequência correta que corresponde, respectivamente, à questão é

Considere a reação entre sulfeto de sódio e peróxido de hidrogênio que produz sulfato de sódio e água.
KMnO4 (aq) +HF (aq) → KF (aq) + MnF2 (aq) + H2O (l) + F2 (g)
Balanceie a equação química e, baseando-se na equação balanceada, assinale a proposição correta acerca dos estados de oxidação das espécies químicas e da estequiometria da reação:
A compreensão dessas informações permite concluir que
Considerando a seguinte série de equações químicas propostas e fazendo o balanceamento destas equações,
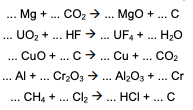
é INCORRETO afirmar que:
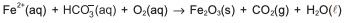
A presença de sais de ferro, a exemplo de bicarbonato de ferro (II), Fe(HCO3)2(aq), na água de abastecimento, deixa manchas de cor marrom quando a água goteja sobre a superfície de azulejos, pisos e vasos sanitários, em razão da formação de depósitos de óxido de ferro (III), Fe2O3(s).
Após análise dessas informações e do balanceamento da
equação química com coeficientes estequiométricos inteiros,
é correto afirmar:
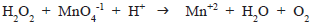
A soma total dos coeficientes dessa equação após o devido balanceamento é igual a
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

O paracetamol (C8H9NO2) é o princípio ativo do medicamento Tylenol®, utilizado como analgésico e antitérmico. Pode ser comercializado na forma de solução oral (200 mg.mL–1) ou comprimido (500 mg ou 750 mg). É um dos analgésicos mais utilizados, porém é altamente perigoso para o fígado, devido ao seu alto potencial hepatotóxico, não devendo ser utilizados mais do que 8 comprimidos de 500 mg ao dia. Com base nessas informações, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.

Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
A fórmula mínima da vitamina C é C3H4O3.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
Em meio mol do sal, existem 2 mols de átomos de alumínio.