Questões de Vestibular
Sobre fórmulas, balanceamento e leis ponderais das reações químicas em química
Foram encontradas 379 questões
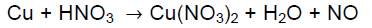
Quando balanceada, a soma dos menores coeficientes inteiros estequiométricos é igual a
Dados: MM(H) = 1 g.mol-1 , MM(C) = 12 g.mol-1 e MM(O) = 16 g.mol-1

Quando se balancear uma reação química, deve-se obedecer à lei da conservação da massa. Ao se balancear reações de oxirredução, existe uma exigência adicional: os elétrons recebidos e doados devem estar balanceados.
Desta forma, é correto afirmar que a reação de oxirredução entre o íon permanganato e o íon oxalato em solução aquosa ácida, representada abaixo, estará balanceada quando os coeficientes estequiométricos forem, respectivamente:
MnO4- (aq) + C2O42- (aq) + H+ (aq) Mn2+ (aq) + H2O (l) + CO2 (g)
Mn2+ (aq) + H2O (l) + CO2 (g)
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
A produção da alumina a partir da bauxita, minério de alumínio, envolve uma série de etapas. Entre elas está a calcinação, na qual ocorre a seguinte reação:
Al(OH)3 ----> Al2 O3 + H2O
O balanceamento correto dessa reação, com os menores números inteiros, é dado, respectivamente, por:
Em motores de foguetes, ocorre a seguinte reação de hidrazina com peróxido de hidrogênio:
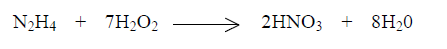
Para a produção de 630,1 gramas de ácido nítrico, são necessários quantos mols de hidrazina (N2H4)?
Observe a reação abaixo, que representa a adição de uma solução de permanganato de potássio em uma solução de ácido clorídrico.
KMnO4(aq) + HCI(aq) → KCI(aq) + MnCI2(aq) + CI2(g) + H2O(I)
O coeficiente estequiométrico do ácido clorídrico
da reação balanceada é
A glicose, importante açúcar na alimentação de muitos seres vivos, possui fórmula igual a C6 H12O6 .
Sobre a glicose, é possível AFIRMAR que:
O fermento químico é um ingrediente muito utilizado na cozinha para fazer crescer as massas, sendo a principal a de farinha de trigo. O crescimento ocorre devido à formação de gás carbônico dentro da massa, quando o fermento é adicionado a ela. Graças a ele, podemos provar alimentos macios e de digestão fácil. Observe a reação entre as substâncias que compõem um determinado fermento químico, quando o mesmo é adicionado à massa de um alimento que está sendo produzido:
8NaHCO3 + 3Ca(H2PO4)2 → Ca3(PO4)2 + 4Na2HPO4 + 8CO2 + 8H2O
Considerando a reação dada, qual é a massa, em gramas, de CO2 produzido quando 60 gramas de NaHCO3 reagem totalmente com Ca(H2PO4)2?
Dados: NaHCO3: 84 g/mol; CO2: 44 g/mol
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
O dióxido de titânio, além de ser empregado como aditivo alimentar, é comumente usado para pigmentação branca em tintas, papel e plásticos. É também um ingrediente ativo, em protetores solares baseados em minerais, usado para a pigmentação com o objetivo de bloquear a luz ultravioleta. Além disso, o óxido também é usado em alguns chocolates para dar uma textura suave; em donuts, para fornecer cor; e em leites desnatados, para dar uma aparência mais brilhante, mais opaca, o que torna o produto mais saboroso.
Uma das reações utilizadas para a sua produção é a cloração de um mineral de titânio (ilmenita) cuja equação é a seguinte:
x FeTiO3 (s) + y Cl2 (g) + z C(s) → a FeCl2 (s) + bTiO2(s) + c CO2 (g)
Os números para os coeficientes x, y, z, a, b, c, que tornam
essa equação balanceada, são, respectivamente:
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
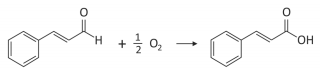
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
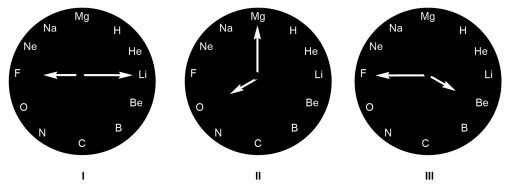
As substâncias neutras formadas a partir da leitura das horas marcadas nos relógios I, II e III são, respectivamente:
HABER-BOSCH: O PROCESSO RESPONSÁVEL POR ALIMENTAR
MUITA GENTE NESTE PLANETA
Estima-se que aproximadamente 45% da população mundial só estão aqui em função do desenvolvimento do processo Haber-Bosch e da produção de amônia. Sem os fertilizantes nitrogenados, nós não teríamos condições de produzir a quantidade de alimentos necessária para alimentar a população que temos hoje no mundo, que está em torno de 7,3 bilhões de pessoas, com tendência a chegar a 9 ou 10 bilhões por volta de 2050. O processo Haber-Bosh descreve uma técnica para obtenção da amônia a partir do nitrogênio do ar atmosférico e do hidrogênio e de fatores como altas temperaturas e pressão.
Disponível em:<https://www.acontecenoticias.com.br/single-post/2017/09/27/Haber-Bosch-O-Processo-Respons%C3%A1velpor-Alimentar-Muita-Gente-Neste-Planeta> . Acesso em: 01/04/18.
A equação não balanceada que descreve a reação de produção de amônia é mostrada a seguir:
N2(g) +H2(g) ⇌ NH3(g)
Ao reagir 50 mols de N2 e 30 mols de H2, qual a quantidade de NH3 produzida em gramas se a reação de síntese for completa?
Dados: N=14 g/mol; H=1g/mol
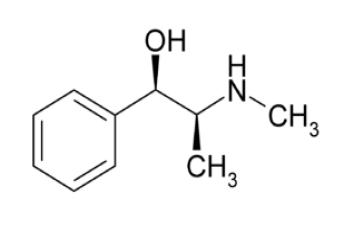 Com relação a essa molécula, podemos afirmar,
respectivamente, que sua fórmula molecular e os grupos
funcionais presentes correspondem às funções orgânicas:
Com relação a essa molécula, podemos afirmar,
respectivamente, que sua fórmula molecular e os grupos
funcionais presentes correspondem às funções orgânicas:Considere a representação tridimensional da molécula orgânica mostrada abaixo.
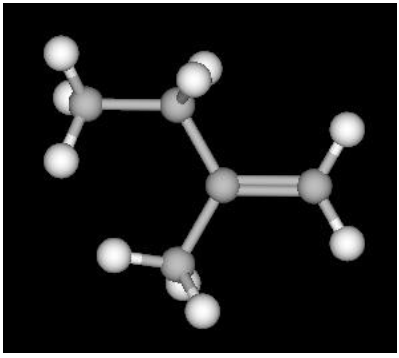
Sobre essa molécula, é correto afirmar que
Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo, referentes a compostos inorgânicos.
( ) O fosfato de sódio, embora seja considerado um composto iônico, possui ligações covalentes no íon fosfato.
( ) Compostos iônicos tendem a ter pontos de fusão e ebulição mais elevados do que os compostos moleculares.
( ) BeF2 não obedece à regra do octeto.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é

